|
Acido magico
L'acido magico è il superacido costituito da una miscela di acido fluorosolforico (HSO3F) e pentafluoruro di antimonio (SbF5), in genere in rapporto molare 1:1. Questo superacido fu sviluppato negli anni sessanta nel laboratorio di George A. Olah alla Case Western Reserve University di Cleveland, ed è stato usato per stabilizzare in fase liquida carbocationi classici e ioni carbonio ipercoordinati. L'acido magico e altri superacidi possono anche catalizzare l'isomerizzazione di alcani, nonché protonare basi molto deboli come metano, xeno, alogeni e idrogeno molecolare.[1]
Storia
Il termine "superacido" fu usato per la prima volta nel 1927 quando James Bryant Conant trovò che l'acido perclorico può protonare chetoni e aldeidi in soluzioni non acquose formando sali. Negli anni sessanta Olah iniziò ad usare la miscela acido fluorosolforico/pentafluoruro di antimonio per studiare carbocationi stabili.[2] Anche Ronald Gillespie usò questo sistema acido per generare cationi inorganici elettron-deficienti. Il nome "acido magico" nacque dopo una festa natalizia nel 1966, quando Joachim Lukas, uno dei membri del laboratorio di Olah, pose un pezzo di candela di paraffina nell'acido, e vide che si scioglieva rapidamente. Lo spettro 1H-NMR della soluzione indicò la presenza del catione ter-butile, suggerendo che la catena paraffinica che forma la cera era stata spezzata e quindi isomerizzata. Il nome "acido magico" apparve in una pubblicazione del laboratorio di Olah ed è ora un marchio registrato.[3] In seguito, negli anni settanta Gillespie propose di definire superacido qualsiasi acido più forte dell'acido solforico puro. Nel 1994 Olah vinse il premio Nobel per la chimica per le sue ricerche sui carbocationi.
Struttura
L'elevata acidità dell'acido magico è dovuta alla combinazione di un acido di Brønsted (l'acido fluorosolforico, HSO3F) con un acido di Lewis (il pentafluoruro di antimonio, SbF5), in genere utilizzati in rapporto molare 1:1. I componenti della miscela danno luogo ad un equilibrio rappresentabile in forma semplificata come:[4]
![{\displaystyle {\ce {2HSO3F + SbF5 <=> [H2SO3F]^+ + [F5SbOSO2F]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/255aa0209f9a8a3af932b27cd7ba203ba6231a86)
In questa reazione l'acido fluorosolforico si comporta, nei confronti di SbF5 come una base di Lewis, e l'addotto che così si forma risulta un acido di Brønsted notevolmente più forte di HSO3F.
In realtà gli equilibri che si stabiliscono sono molto più complessi e si formano anche specie tipo [SbF6]–, [Sb2F11]– e altre.[5]
Forza acida
Per quantificare la forza di acidi molto forti si usa la funzione di acidità di Hammett, H0. Su questa scala, l'acidità dell'acido solforico concentrato (18,4 M) ha H0 = –12, mentre per una miscela di acido magico HSO3F-SbF5 1:1 si ha H0 = –23. Dato che la funzione di Hammett è logaritmica, ciò significa che l'acido magico è 1011 volte più forte dell'acido solforico. Il più forte superacido conosciuto è l'acido fluoroantimonico che ha H0= –31.
Usi
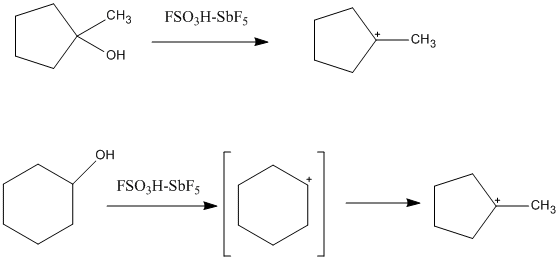
L'anione dell'acido magico ha una bassissima basicità e bassa nucleofilia e questo favorisce la stabilità dei carbocationi in soluzione. Si possono così osservare i "classici" carbocationi trivalenti in ambiente acido e vedere che sono planari con ibridazione sp2. L'atomo di carbonio ha qui solo sei elettroni nel livello più esterno; questo, e la carica positiva che porta su di sé, lo rende un forte acido di Lewis e, data anche la planarità che agevola l'avvicinamento di eventuali nucleofili, lo rende anche fortemente elettrofilo. In soluzioni di superacidi si possono formare anche cationi terziari cicloalchilici. Un esempio è il catione 1-metil-1-ciclopentile, che si forma da precursori con anelli a cinque o sei termini. Nel caso dell'anello a sei termini si forma prima il carbocatione secondario, che poi si riarrangia al più stabile carbocatione terziario con ciclo a cinque termini. Sono stati osservati anche carbocationi ciclopropenilici, alchenilici e arenici.
La diffusione dell'utilizzo dell'acido magico ha permesso di osservare carbocationi a più alto numero di coordinazione. I carbocationi pentacoordinati, descritti anche come ioni non classici, non possono essere rappresentati con i soliti legami a due centri e due elettroni, e richiedono legami a tre (o più) centri e due elettroni. In questi ioni ci sono due elettroni delocalizzati su più di due atomi, rendendo queste posizioni così elettron-deficienti da indurre anche alcani saturi a partecipare a reazioni elettrofile.[1] La scoperta dei carbocationi ipercoordinati ha alimentato la controversia sugli ioni non classici negli anni cinquanta e sessanta. La rapida equilibrazione delle cariche positive sugli atomi di idrogeno avrebbe potuto sfuggire a causa della bassa risoluzione temporale della spettroscopia 1H-RNM. Tuttavia, sistemi con carbocationi a ponte sono stati studiati con Spettroscopia IR, Raman e
13C-RNM. Un catione controverso come il norbornile è stato osservato in vari ambienti, incluso l'acido magico.[6]
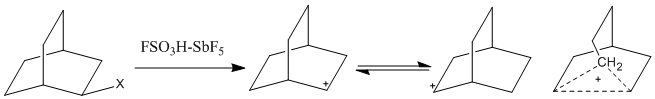
L'atomo di carbonio del ponte metilenico è pentacoordinato, con tre legami a due centri e due elettroni e un legame a tre centri e due elettroni con il rimanente orbitale sp3. Calcoli quantomeccanici hanno mostrato che il modello classico non corrisponde a un minimo di energia.[6]
Reazioni con alcani
L'acido magico è in grado di protonare alcani. Ad esempio, il metano reagisce a 140 °C e pressione atmosferica formando lo ione CH5+. Come prodotti secondari si formano anche idrogeno gassoso e idrocarburi a più alto peso molecolare.
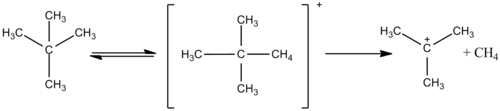
In presenza di DSO3F al posto di HSO3F il metano scambia atomi di idrogeno con atomi di deuterio, e viene rilasciato HD anziché H2. Questo fatto suggerisce che in queste reazioni il metano agisce da base, accettando un protone dall'ambiente acido per formare CH5+. Il seguito questo ione viene deprotonato, spiegando lo scambio di idrogeno, o perde una molecola di idrogeno formando il carbocatione CH3+. Questa specie è molto reattiva, e può portare alla formazione di parecchi nuovi carbocationi, come mostrato nella figura seguente:[7]

Anche alcani più grandi come l'etano reagiscono in acido magico, scambiando atomi di idrogeno e condensando in carbocationi più grandi come il neopentano protonato. Questo catione si rompe a temperature più elevate; reagisce liberando idrogeno e formando il catione tert-butile a temperatura minore.
Catalisi con idroperossidi
L'acido magico catalizza le reazioni di rottura e riarrangiamento di idroperossidi terziari e alcoli terziari. Utilizzando un ambiente superacido si sono potuti osservare i carbocationi intermedi di reazione. Si è determinato che il meccanismo dipende dalla quantità di acido magico usato. Con quantità equimolecolari si osservano solo rotture O–O, mentre al crescere dell'eccesso di acido magico le rotture C–O competono con quelle O–O. Presumibilmente l'eccesso di acido magico disattiva il perossido di idrogeno formato nell'eterolisi C–O.[8]
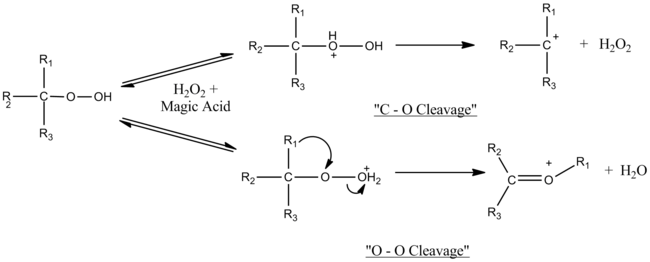
L'acido magico catalizza anche la idrossilazione elettrofila di composti aromatici con perossido di idrogeno, portando a prodotti monoidrossilati con alta resa. In soluzioni di superacidi i fenoli esistono come specie completamente protonate; quando sono i prodotti della reazione risultano disattivati nei confronti di ulteriori attacchi elettrofili. L'effettivo agente idrossilante è il perossido di idrogeno protonato.[9]
Catalisi con ozono
L'ossigenazione di alcani in presenza di ozono può essere catalizzata con soluzioni di acido magico e SO2ClF. Il meccanismo è simile a quello della protolisi di alcani, con una inserzione elettrofila nei legami singoli dell'alcano. Lo stato di transizione del complesso idrocarburo-ozono contiene un carbonio pentacoordinato.[10]
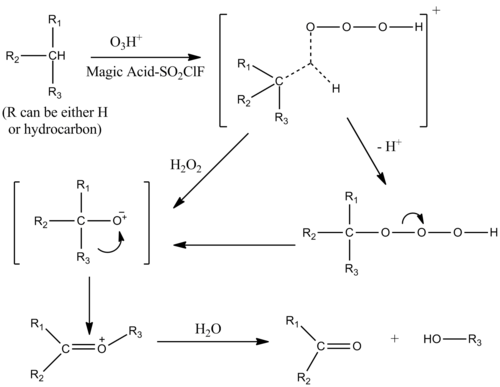
Anche alcoli, chetoni e aldeidi possono essere ossigenati per inserzione elettrofila.[11]
Indicazioni di sicurezza
L'acido magico è commercializzato dalla Sigma-Aldrich. È un liquido tossico per inalazione e nocivo per ingestione. Per contatto provoca gravi ustioni a pelle, mucose e occhi. Non ci sono dati che indichino proprietà cancerogene. È tossico per gli organismi acquatici con effetti di lunga durata.[12]
Note
Bibliografia
- A. Commeyras e G. A. Olah, Chemistry in super acids. II. Nuclear magnetic resonance and laser Raman spectroscopic study of the antimony pentafluoride-fluorosulfuric acid (sulfur dioxide) solvent system (magic acid). The effect of added halides, water, alcohols, and carboxylic acids. Study of the hydronium ion, in J. Am. Chem. Soc., vol. 91, n. 11, 1969, pp. 2929–2942, DOI:10.1021/ja01039a019. URL consultato il 20 febbraio 2012.
- C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- G. A. Olah e R. H. Schlosberg, Chemistry in super acids. I. Hydrogen exchange and polycondensation of methane and alkanes in FSO3H-SbF5 ("magic acid") solution. Protonation of alkanes and the intermediacy of CH5+ and related hydrocarbon ions. The high chemical reactivity of "paraffins" in ionic solution reactions, in J. Am. Chem. Soc., vol. 90, n. 10, 1968, pp. 2726–2727, DOI:10.1021/ja01012a066. URL consultato il 23 febbraio 2012.
- G. A. Olah, Carbocations and Electrophilic Reactions, in Angew. Chem. Int. Ed. Engl., vol. 12, n. 3, 1973, pp. 173–212, DOI:10.1002/anie.197301731. URL consultato il 23 febbraio 2012.
- G. A. Olah, D. G. Parker, N. Yoneda e F. Pelizza, Oxyfunctionalization of hydrocarbons. 1. Protolytic cleavage-rearrangement reactions of tertiary alkyl hydroperoxides with magic acid, in J. Am. Chem. Soc., vol. 98, n. 8, 1976, pp. 2245–2250, DOI:10.1021/ja00424a038. URL consultato il 23 febbraio 2012.
- G. A. Olah, N. Yoneda e R. Ohnishi, Oxyfunctionalization of hydrocarbons. 6. Electrophilic oxygenation of aliphatic alcohols, ketones, and aldehydes with ozone in superacids. Preparation of bifunctional derivatives, in J. Am. Chem. Soc., vol. 98, n. 23, 1976, pp. 7341–7345, DOI:10.1021/ja00439a038. URL consultato il 23 febbraio 2012.
- G. A. Olah, N. Yoneda e D. G. Parker, Oxyfunctionalization of hydrocarbons. 3. Superacid catalyzed oxygenation of alkanes with ozone involving protonated ozone, O3H+, in J. Am. Chem. Soc., vol. 98, n. 17, 1976, pp. 5261–5268, DOI:10.1021/ja00433a035. URL consultato il 23 febbraio 2012.
- G. A. Olah e R. Ohnishi, Oxyfunctionalization of hydrocarbons. 8. Electrophilic hydroxylation of benzene, alkylbenzenes, and halobenzenes with hydrogen peroxide in superacids, in J. Org. Chem., vol. 43, n. 5, 1978, pp. 865–867, DOI:10.1021/jo00399a014. URL consultato il 23 febbraio 2012.
- G. A. Olah, Crossing Conventional Boundaries in Half a Century of Research, in J. Org. Chem., vol. 70, n. 7, 2005, pp. 2413–2429, DOI:10.1021/jo040285o. URL consultato il 20 febbraio 2012.
- G. A. Olah, G. K. S. Prakash, A. Molnàr e J. Sommer, Superacid Chemistry, 2ª ed., New York, John Wiley and Sons, 2009, ISBN 978-0-471-59668-4.
Altri progetti
 Portale Chimica Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia |
|