Vanadyl diiodide
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

Just Stand Up!Singel oleh Artists Stand Up To CancerDirilis21 Agustus 2008 (2008-08-21) (digital) 30 September 2008 (2008-09-30) (CD single)FormatDigital download, CD singleDirekam2008GenrePop, R&BDurasi3:34PenciptaBabyface, Ronnie WaltonProduserBabyface, Antonio L.A. Reid Just Stand Up! adalah singel amal untuk penggalangan dana bagi penderita kanker. Lagu ini rilis pada tanggal 21 Agustus 2008. Lagu ini dinyanyikan secara langsung di TV ABC, NBC, CBS pada tanggal 5 September 2...

Mazmur 123Naskah Gulungan Mazmur 11Q5 di antara Naskah Laut Mati memuat salinan sejumlah besar mazmur Alkitab yang diperkirakan dibuat pada abad ke-2 SM.KitabKitab MazmurKategoriKetuvimBagian Alkitab KristenPerjanjian LamaUrutan dalamKitab Kristen19← Mazmur 122 Mazmur 124 → Mazmur 123 (disingkat Maz 123 atau Mz 123; penomoran Septuaginta: Mazmur 122) adalah sebuah mazmur dalam bagian ke-5 Kitab Mazmur di Alkitab Ibrani dan Perjanjian Lama dalam Alkitab Kristen. Tidak ada catatan n...

Pour les articles homonymes, voir Lucien Hubert et Hubert. Lucien Hubert Fonctions Vice-président du conseil et Garde des Sceaux, ministre de la Justice 3 novembre 1929 – 21 février 1930(3 mois et 18 jours) Président Gaston Doumergue Gouvernement premier gouvernement de André Tardieu Successeur Paul Reynaud Sénateur des Ardennes 1er janvier 1912 – 1er janvier 1938(26 ans) Député des Ardennes 11 avril 1897 – 19 janvier 1912(14 ans, 9 mois et 8 jours)...

AbunKecamatanAbunPeta lokasi Kecamatan AbunTampilkan peta Semenanjung Kepala BurungAbunAbun (Indonesia)Tampilkan peta IndonesiaKoordinat: 0°23′S 132°40′E / 0.383°S 132.667°E / -0.383; 132.667Koordinat: 0°23′S 132°40′E / 0.383°S 132.667°E / -0.383; 132.667Negara IndonesiaProvinsiPapua Barat DayaKabupatenTambrauwLuas[1] • Total845,91 km2 (326,61 sq mi)Populasi (Desember 2022)[2]&...

Carmelo Di Bella Carmelo Di Bella a bordocampo Nazionalità Italia Calcio Ruolo Allenatore (ex centrocampista) Termine carriera 1954 - giocatore1981 - allenatore Carriera Giovanili 193?-1938 Catania Squadre di club1 1938-1941 Catania35 (7)1941-1943 Palermo-Juventina33 (6)[1]1944-1949 Palermo103 (20+)1949-1950 Igea Virtus18 (3)[2]1950-1952 Marsala? (?)1952-1954 Akragas? (?) Carriera da allenatore 1950 Igea Virtus1951-1952 Mars...

Series of strikes vteMetal mining strikes 1800s Upper Peninsula 1865 Coeur d'Alene 1892 Cripple Creek 1894 Leadville 1896–97 Coeur d'Alene 1899 1900s–1920s Colorado Labor Wars (Idaho Springs) 1903–04 Cananea 1906 Goldfield 1906–07 Copper Country 1913–14 Bisbee 1917 Anaconda Road 1920 1930s–1970s Empire Zinc 1950 Murdochville 1957 Inco 1978 The Goldfield, Nevada labor troubles of 1906–1907 were a series of strikes and a lockout which pitted gold miners and other laborers, represe...

Mexican mixed martial arts fighter Efraín EscuderoEfraín EscuderoBorn (1986-01-15) January 15, 1986 (age 38)San Luis Rio Colorado, Sonora, Mexico[1]Other namesHecho En México[1]Height5 ft 9 in (175 cm)Weight155 lb (70 kg; 11.1 st)DivisionLightweightReach70 in (180 cm)[2]StyleWrestlingFighting out ofSomerton, Arizona, U.S.TeamMMA LabRankBrown belt in Brazilian Jiu-Jitsu under John Crouch[1]WrestlingNCAA wrestling&#...

2022 studio album by DrakeHonestly, NevermindStudio album by DrakeReleasedJune 17, 2022 (2022-06-17)GenreDanceLength52:32Label OVO Republic Producer &ME 40 Alex Lustig Beau Nox Black Coffee Esona Tyolo Gordo Govi Ginton Johannes Klahr Kid Masterpiece Nyan Lieberthal Rampa Richard Zastenker Sona Tay Keith Vinylz Vlado Wondra030 Drake chronology Certified Lover Boy(2021) Honestly, Nevermind(2022) Her Loss(2022) Singles from Honestly, Nevermind Sticky / MassiveRelease...

Image created by light falling on a light-sensitive surface Photos redirects here. For the Apple application, see Photos (Apple). For the Microsoft application, see Microsoft Photos. For other uses, see Photograph (disambiguation). For the technique, see Photography. The earliest known surviving product of Nicéphore Niépce's heliography process, 1825. It is an ink on paper print and reproduces a 17th-century Flemish engraving showing a man leading a horse. View from the Window at Le Gras (1...

يفتقر محتوى هذه المقالة إلى الاستشهاد بمصادر. فضلاً، ساهم في تطوير هذه المقالة من خلال إضافة مصادر موثوق بها. أي معلومات غير موثقة يمكن التشكيك بها وإزالتها. (ديسمبر 2018) كأس السوبر الألباني 2013الحدثكأس السوبر الألباني سكندربيو كورتشه إياتشي 1 1 فاز سكندربيو كورتشه 4–3 برك�...

この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。出典を追加して記事の信頼性向上にご協力ください。(このテンプレートの使い方)出典検索?: コルク – ニュース · 書籍 · スカラー · CiNii · J-STAGE · NDL · dlib.jp · ジャパンサーチ · TWL(2017年4月) コルクを打ち抜いて作った瓶の栓 コルク(木栓、�...

Eurovision Song Contest 2022Country AzerbaijanNational selectionSelection processInternal selectionSelection date(s)Artist: 16 February 2022Song: 21 March 2022Selected entrantNadir RustamliSelected songFade to BlackSelected songwriter(s)Andreas Stone JohanssonAnderz WrethovSebastian SchubThomas StengaardFinals performanceSemi-final resultQualified (10th, 96 points)Final result16th, 106 pointsAzerbaijan in the Eurovision Song Contest ◄2021 • 2022 �...

Частина серії проФілософіяLeft to right: Plato, Kant, Nietzsche, Buddha, Confucius, AverroesПлатонКантНіцшеБуддаКонфуційАверроес Філософи Епістемологи Естетики Етики Логіки Метафізики Соціально-політичні філософи Традиції Аналітична Арістотелівська Африканська Близькосхідна іранська Буддій�...

Souvignargues L'église paroissiale Saint-André à Souvignargues. Blason Administration Pays France Région Occitanie Département Gard Arrondissement Nîmes Intercommunalité Communauté de communes du Pays de Sommières Maire Mandat Catherine Lecerf 2020-2026 Code postal 30250 Code commune 30324 Démographie Gentilé Souvignarguais Populationmunicipale 908 hab. (2021 ) Densité 82 hab./km2 Géographie Coordonnées 43° 48′ 53″ nord, 4° 07′ 23″&#...
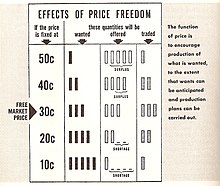
Form of market-based economy For economic systems where markets (either free or regulated) are the primary allocation mechanism, see Market economy. Free enterprise redirects here. For other uses, see Free enterprise (disambiguation). Part of a series onEconomic systems Major types Capitalism Socialism Communism By ideology Associative Capitalist Corporate Democratic Laissez-faire Mercantilist Neoliberal Neomercantilist Protectionist Social market State Welfare Democratic Fascist Feminist Geo...

1005 treaty between the Liao and Song Chanyuan Treaty The Chanyuan Treaty (simplified Chinese: 澶渊之盟; traditional Chinese: 澶淵之盟; pinyin: Chányuān Zhī Méng) was signed between the Northern Song dynasty and the Liao dynasty in 1005, and marked a pivotal point in Chinese history and in the relations between the two dynasties. The treaty laid the foundation for approximately a century of relative peace between the two major powers, which lasted until the Alliance Co...

Italian politician (1933–2021) This section needs additional citations for verification. Please help improve this article by adding citations to reliable sources in this section. Unsourced material may be challenged and removed.Find sources: Franco Marini – news · newspapers · books · scholar · JSTOR (February 2021) (Learn how and when to remove this message) Franco MariniPresident of the Senate of the RepublicIn office29 April 2006 – ...

South Slavic ethnic group Not to be confused with Sorbs. Serbians and Serbian people redirect here. For information on the population of Serbia, see Serbians (demonym). Ethnic group SerbsСрбиSrbiTotal populationc. 10 million* Regions with significant populations Serbia 5,360,239 (2022) Bosnia and Herzegovina 1,086,733 (2013)[1]Other regions Southern Europe Croatia123,892 (2021)[2] Montenegro**200,000(2023)est.[3] Kosovo95,962 (2016 est.)&#...

Province of Argentina Province in Santiago del Estero, ArgentinaSantiago del EsteroProvinceProvince of Santiago del EsteroProvincia de Santiago del Estero (Spanish)The Bicentennial Cultural Center FlagCoat of armsLocation of Santiago del Estero within ArgentinaCountryArgentinaCapitalSantiago del EsteroDepartments27Municipalities28Government • GovernorGerardo Zamora (FCpS) • LegislatureChamber of Deputies (40) • National Deputies7 • National Sena...

This article does not cite any sources. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Italian 1st Eritrean Division – news · newspapers · books · scholar · JSTOR (December 2008) (Learn how and when to remove this message) The First Eritrean Division or I Division Indigeni (Native) was organized for service in the Second Italo-Abyssinian War in 1935. It was formed...