三溴化磷为淡黃色發煙無色液體,有刺激性臭味,具腐蝕性。可溶於丙酮、二硫化碳、氯仿、四氯化碳。目前用於化學分析和有机合成,或作為催化劑。
三溴化磷對眼睛、皮膚、粘膜和呼吸道有強烈的刺激性。人體經呼吸吸入、誤食或皮膚接觸後,會產生燒灼感、咳嗽、喘息、喉炎、氣短、頭痛、恶心和嘔吐。
制备
三溴化磷可通过单质磷与溴化合制备,以PBr3自身作溶剂(白磷可溶于其中):
- P4 + 6 Br2 → 4 PBr3
磷要过量,否则会生成五溴化磷。
反应及有机合成应用
三溴化磷与水反应,生成溴化氢和亚磷酸,反应激烈时会发生爆炸:
- PBr3 + 3 H2O → H3PO3 + 3 HBr
三溴化磷和三氯化磷、三氟化磷类似,都可作为路易斯酸或路易斯碱。一方面,它可与三溴化硼生成1:1加合物Br3B-PBr3;另一方面,它也可作为亲电试剂与胺反应。
PBr3最常用作转化醇为溴代烃,分子中的三个溴原子都可溴化:[1]
- PBr3 + 3 ROH → 3 RBr + HP(O)(OH)2
机理涉及SN2亲核取代反应,如下图所示:
![]()
由于机理的缘故,该反应只对一级和二级醇起作用,而且反应后α碳发生构型翻转。
类似地,三溴化磷也可与羧酸反应生成酰溴:
- PBr3 + 3 RCOOH → 3 RCOBr + HP(O)(OH)2
三溴化磷也可用作羧酸α氢溴化反应中的催化剂,制取Hell-Volhard-Zelinsky反应反应物酰溴的前体[2] 以及合成药物等。
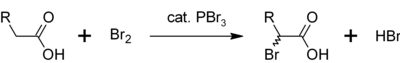
三溴化磷是强还原剂,与氧气的反应比三氯化磷更加激烈,最终爆炸性生成P2O5和Br2。
参考资料
- ^ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Edition, Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.