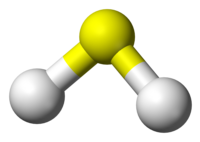
硫化氫
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

Montagu LoveLahir(1877-03-15)15 Maret 1877Portsmouth, Hampshire, Inggris, Britania RayaMeninggal17 Mei 1943(1943-05-17) (umur 66)Beverly Hills, California, Amerika SerikatNama lainHarry Montagu LovePekerjaanPemeranTahun aktif1914–1943Suami/istriMarjorie Hollis Love (1929-1943) (kematiannya)Gertrude Stainer Love (1906-1928) (bercerai) Harry Montagu Love (15 Maret 1877 – 17 Mei 1943) adalah seorang pemeran layar lebar, panggung dan vaudeville asal Inggris. ...

العلاقات النيبالية الميكرونيسية نيبال ولايات ميكرونيسيا المتحدة نيبال ولايات ميكرونيسيا المتحدة تعديل مصدري - تعديل العلاقات النيبالية الميكرونيسية هي العلاقات الثنائية التي تجمع بين نيبال وولايات ميكرونيسيا المتحدة.[1][2][3][4][5] مقا...

يفتقر محتوى هذه المقالة إلى الاستشهاد بمصادر. فضلاً، ساهم في تطوير هذه المقالة من خلال إضافة مصادر موثوق بها. أي معلومات غير موثقة يمكن التشكيك بها وإزالتها. (نوفمبر 2019) كأس أندورا 2010 تفاصيل الموسم كأس أندورا النسخة 18 البلد أندورا التاريخ بداية:17 يناير 2010 نهاية:...

Airliner with a single aisle Four-abreast cross-section Narrow-body Boeing 737-300 in front of a Boeing 777-300ER wide-body A narrow-body aircraft or single-aisle aircraft is an airliner arranged along a single aisle, permitting up to 6-abreast seating in a cabin less than 4 metres (13 ft) in width. In contrast, a wide-body aircraft is a larger airliner usually configured with multiple aisles and a fuselage diameter of more than 5 metres (16 ft), allowing at least seven-abreast seat...

Overview of education in Egypt This article is part of a series onLife in Egypt Culture Architecture Ancient Egyptian art Contemporary Cinema Cuisine Dance Belly dance Raqs sharqi Baladi Tahtib Tanoura Fashion History Holidays Language Literature Music Mythology Radio Sculpture Sport Symbols Flag Anthem Television Society People Identity Education Demographics Health Media Human rights Religion Wildlife World Heritage Sites Politics Presidency Government Parliament Political parties Military ...

Danish rapper TopGunnBackground informationBirth nameOliver Gammelgaard NielsenBorn (1991-04-03) 3 April 1991 (age 33)Frederiksberg, Copenhagen, DenmarkGenresRap, dancehallOccupation(s)RapperYears active2010–presentLabelsCHEFF RecordsMusical artist Oliver Gammelgaard Nielsen better known by his stage name TopGunn (born 3 April 1991[1]) is a Danish rapper and music producer from Nørrebro, Copenhagen, born in Frederiksberg, Copenhagen. He has also established his own label CHEFF...

The Honeymoon TourAriana Grande mentre si esibisce a Giacarta nell'agosto 2015Tour di Ariana GrandeAlbumMy Everything Inizio Independence 25 febbraio 2015 Fine San Paolo 25 ottobre 2015 Spettacoli64 in Nord America16 in Europa5 in Asia3 in Sud America88 totali Cronologia dei tour di Ariana Grande The Listening Session(2013) Dangerous Woman Tour(2017) The Honeymoon Tour è stato il primo tour mondiale della cantante statunitense Ariana Grande, a supporto del suo secondo album in studio My Ever...

Artikel ini perlu diwikifikasi agar memenuhi standar kualitas Wikipedia. Anda dapat memberikan bantuan berupa penambahan pranala dalam, atau dengan merapikan tata letak dari artikel ini. Untuk keterangan lebih lanjut, klik [tampil] di bagian kanan. Mengganti markah HTML dengan markah wiki bila dimungkinkan. Tambahkan pranala wiki. Bila dirasa perlu, buatlah pautan ke artikel wiki lainnya dengan cara menambahkan [[ dan ]] pada kata yang bersangkutan (lihat WP:LINK untuk keterangan lebih lanjut...

此条目序言章节没有充分总结全文内容要点。 (2019年3月21日)请考虑扩充序言,清晰概述条目所有重點。请在条目的讨论页讨论此问题。 哈萨克斯坦總統哈薩克總統旗現任Қасым-Жомарт Кемелұлы Тоқаев卡瑟姆若马尔特·托卡耶夫自2019年3月20日在任任期7年首任努尔苏丹·纳扎尔巴耶夫设立1990年4月24日(哈薩克蘇維埃社會主義共和國總統) 哈萨克斯坦 哈萨克斯坦政府...

Michele Palmierivescovo della Chiesa cattolica Incarichi ricoperti Vescovo di Mottola (1798-1804) Vescovo di Troia (1804-1824) Vescovo di Monopoli (1824-1842) Nato30 settembre 1757 a Monopoli Ordinato presbitero18 dicembre 1773 Nominato vescovo29 gennaio 1798 da papa Pio VI Consacrato vescovo2 febbraio 1798 dal cardinale Giulio Maria della Somaglia Deceduto24 novembre 1842 (85 anni) a Monopoli Manuale Michele Palmieri (Monopoli, 30 settembre 1757 – Monopoli, 24 novem...

Artikel ini memberikan informasi dasar tentang topik kesehatan. Informasi dalam artikel ini hanya boleh digunakan untuk penjelasan ilmiah; bukan untuk diagnosis diri dan tidak dapat menggantikan diagnosis medis. Wikipedia tidak memberikan konsultasi medis. Jika Anda perlu bantuan atau hendak berobat, berkonsultasilah dengan tenaga kesehatan profesional. Kanker usus besarLokasi dan tampilan dua contoh tumor kolorektalInformasi umumNama lainKanker usus besar, kanker dubur, kanker ususSpesialisa...

American actor (1923–2006) For other people named Chris Drake, see Chris Drake (disambiguation). Chris DrakeMitsuko Kimura and Christian Drake in Forever My Love (Itsu itsu made mo), 1952BornJames Christian Droste(1923-12-11)December 11, 1923near Richmond, Virginia, U.S.DiedJuly 9, 2006(2006-07-09) (aged 82)Williamsburg, Virginia, U.S.OccupationActorYears active1944-1961SpouseMargaret Shobe (m. 1958-2006; his death)Children4 children Chris Drake (born James Christian Droste, Decem...

Индианаполис 500 1954 годаангл. XXXVIIIth Indianapolis International Motor Sweepstakes Дата 30 мая 1954 года Место США, Индианаполис Трасса Индианаполис Мотор Спидвей (4023,4 м) Дистанция 200 кругов, 804,672 км Погода Очень жарко Поул 226,97 км/ч Джек МакГратKurtis Kraft-Offenhauser Быстрый круг 226,17 км/ч29-й круг Дже...

Questa voce sull'argomento centri abitati del Rio de Janeiro è solo un abbozzo. Contribuisci a migliorarla secondo le convenzioni di Wikipedia. Macaécomune Macaé – Veduta LocalizzazioneStato Brasile Stato federato Rio de Janeiro MesoregioneNorte Fluminense MicroregioneMacaé AmministrazioneSindacoWelberth Rezende TerritorioCoordinate22°22′38″S 41°46′34″W22°22′38″S, 41°46′34″W (Macaé) Altitudine2 m s.l.m. Superficie1 216,846 km² Abita...

Latin jazz musician MachitoMachito and Graciela performing at Glen Island Casino, New York, late 1940sBackground informationBirth nameFrancisco Raúl Gutiérrez GrilloAlso known asFrank GrilloBornc. (1909-12-03)December 3, 1909OriginHavana, CubaDiedApril 15, 1984(1984-04-15) (aged 74)LondonGenres Latin jazz Cubop Instrument(s) Singing maracas Years active1928–1984Musical artist Machito (born Francisco Raúl Gutiérrez Grillo, December 3, 1909 – April 15, 1984) was a Latin jazz ...

List of events ← 2013 2012 2011 2014 in Macau → 2015 2016 2017 Decades: 1990s 2000s 2010s 2020s See also:Other events of 2014History of Macau Events from the year 2014 in Macau, China. Incumbents Chief Executive - Fernando Chui President of the Legislative Assembly - Ho Iat Seng Events March 27 March - 8th Asian Film Awards. October 21–26 October - Women's Macau Open 2014. 23–26 October - Men's Macau Open 2014. November 15 November - The establishment of Macau Design Centre in...

Corvette Corvette C6 Coupé Corvette C6 Coupé C6 Verkaufsbezeichnung: Corvette Produktionszeitraum: 2005–2013 Klasse: Sportwagen Karosserieversionen: Coupé, Cabriolet Motoren: Ottomotoren:6,0–7,0 Liter(298–476 kW) Länge: 4435–4459 mm Breite: 1844–1927 mm Höhe: 1246 mm Radstand: 2686 mm Leergewicht: 1418–1538 kg Vorgängermodell Corvette C5 Nachfolgemodell Corvette C7 Die Corvette C6 ist die sechste Auflage des US-amerikanischen Sportwagens Corvette vo...

Southern Sydney sheltered forestSydney Red Gum at Chatswood, AustraliaEcologyRealmAustralasiaBiomeTemperate broadleaf and mixed forestsBordersShale Sandstone Transition ForestBlue Gum High ForestSydney Turpentine-Ironbark ForestSydney Sandstone Ridgetop WoodlandGeographyCountryAustraliaElevation30–90 metres (98–295 ft)Coordinates33°44.306′S 151°5.434′E / 33.738433°S 151.090567°E / -33.738433; 151.090567GeologySandstone, shaleClimate typeHumid subtropi...

Italian motor racing team For the surname, see Forti (surname). FortiFull nameParmalat Forti Ford (1995)Forti Grand Prix (1996)BaseAlessandria, ItalyFounder(s)Guido FortiPaolo GuerciNoted staffGiacomo CaliriDaniele CoronnaRiccardo de MarcoCesare FiorioHans FoucheCarlo GanciaChris RadageSergio RinlandGeorge RytonGiorgio StiranoNoted drivers Luca Badoer Pedro Diniz Andrea Montermini Roberto MorenoFormula One World Championship careerFirst entry1995 Brazilian Grand PrixRaces entered27(43 starts ...

Reformed church originating in continental Europe This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Continental Reformed Protestantism – news · newspapers · books · scholar · JSTOR (March 2024) (Learn how and when to remove this message) Countries with significant Continental Reformed churches. Part of a serie...