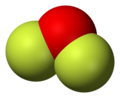
Διφθοριούχο οξυγόνο
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:
Lambang Peta Data dasar Bundesland: Bayern Regierungsbezirk: Oberbayern Ibu kota: Ebersberg Wilayah: 549,30 km² Penduduk: 123.684 (30 September 2005) Kepadatan penduduk: 225 jiwa per km² Nomor pelat kendaraan bermotor: EBE Pembagian administratif: 21 Gemeinden Alamat kantor bupati: Eichthalstraße 585560 Ebersberg Offizielle Situs web resmi: www.landkreis-ebersberg.de Politik Bupati: Gottlieb Fauth (CSU) Peta Ebersberg adalah sebuah distrik (Landkreis) di Bayern, Jerman. lbsBayernLandkreis...

Golden adalah sebuah Munisipalitas Pemerintahan Dalam Negeri yang menjadi kursi kabupaten dari Jefferson County, Colorado, Amerika Serikat.[1] Golden terbentang di sepanjang Clear Creek di pangkal Front Range dari Rocky Mountains. Referensi ^ Find a County. National Association of Counties. Diarsipkan dari versi asli tanggal May 31, 2011. Diakses tanggal June 7, 2011. Pranala luar Wikimedia Commons memiliki media mengenai Golden, Colorado. Panduan perjalanan Golden, Colorado di ...

Sekolah Seni SinematikMotoLimes regiones rerum[1]Moto dalam bahasa InggrisReality ends here[2]JenisSekolah film swastaDidirikan1929Dana abadi$47,277,291[3] DekanElizabeth M. DaleyStaf akademik88 waktu penuh200 bagian[3]Staf administrasi135 waktu penuh300 pekerja murid[3]Sarjana865[3]Magister653[3]Alumni10,500+[3]LokasiLos Angeles, California, Amerika SerikatSitus webcinema.usc.edu Sekolah Seni Sinematik USC (resminya Sekolah...
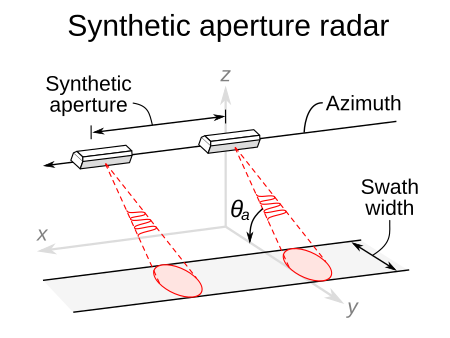
This radar image acquired by the SIR-C/X-SAR radar on board the Space Shuttle Endeavour shows the Teide volcano. The city of Santa Cruz de Tenerife is visible as the purple and white area on the lower right edge of the island. Lava flows at the summit crater appear in shades of green and brown, while vegetation zones appear as areas of purple, green and yellow on the volcano's flanks. Basic principle Illustration of the SAR stripmap operation mode. Depiction of the Spotlight Image Mode Titan ...

Part of a series onBritish law Acts of Parliament of the United Kingdom Year 1801 1802 1803 1804 1805 1806 1807 1808 1809 1810 1811 1812 1813 1814 1815 1816 1817 1818 1819 1820 1821 1822 1823 1824 1825 1826 1827 1828 1829 1830 1831 1832 1833 1834 1835 1836 1837 1838 1839 1840 1841 1842 1843 1844 1845 1846 1847 1848 1849 1850 1851 1852 1853 1854 1855 1856 1857 1858 1859 1860 1861 1862 1863 1864 1865 1866 1867 1868 1869 1870 1871 1872 1873 1874 1875 1876 1877 1878 ...

العلاقات الفيجية المنغولية فيجي منغوليا فيجي منغوليا تعديل مصدري - تعديل العلاقات الفيجية المنغولية هي العلاقات الثنائية التي تجمع بين فيجي ومنغوليا.[1][2][3][4][5] مقارنة بين البلدين هذه مقارنة عامة ومرجعية للدولتين: وجه المقارنة فيجي من...

كاتو مازاراكيون تقسيم إداري البلد اليونان [1] خصائص جغرافية إحداثيات 38°04′13″N 21°39′09″E / 38.07027778°N 21.6525°E / 38.07027778; 21.6525 الارتفاع 135 متر، و139 متر السكان التعداد السكاني 521 (resident population of Greece) (2021)946 (resident population of Greece) (2001)819 (resident population of Greece) (1991)714 (residen...

1942 film by Robert Zigler Leonard We Were DancingDirected byRobert Z. LeonardScreenplay byClaudine WestHans RameauGeorge FroeschelBased onWe Were Dancing1935 playby Noël CowardProduced byRobert Z. LeonardOrville O. DullStarringNorma ShearerMelvyn DouglasCinematographyRobert PlanckEdited byGeorge BoemlerMusic byNoël CowardBronislau KaperDistributed byMetro-Goldwyn-MayerRelease date April 30, 1942 (1942-04-30) (New York)Running time95 minutesCountryUnited StatesLanguageEnglish...

Slogan yang dibuat pada penanda besar di Shekou, Shenzhen (di persimpangan Jalan Nanhai, Jalan Taizi dan Jalan Gongye 1). Waktu adalah Uang, Efisiensi adalah Kehidupan (Hanzi: 时间就是金钱,效率就是生命) adalah sebuah slogan terkenal dari reformasi ekonomi Tiongkok.[1] Slogan tersebut awalnya adalah sebuah kutipan dari Yuan Geng yang dibuat ke publik pada 1981 sebagai direktur Shekou, Shenzhen.[1][2][3] Slogan tersebut seringkali diasosiasikan ...

Sceaux 行政国 フランス地域圏 (Région) イル=ド=フランス地域圏県 (département) オー=ド=セーヌ県郡 (arrondissement) アントニー郡小郡 (canton) 小郡庁所在地INSEEコード 92071郵便番号 92330市長(任期) フィリップ・ローラン(2008年-2014年)自治体間連合 (fr) メトロポール・デュ・グラン・パリ人口動態人口 19,679人(2007年)人口密度 5466人/km2住民の呼称 Scéens地理座標 北緯48度4...

Annual expo of drag culture held in Los Angeles World of Wonder counter at 2019 DragCon LA RuPaul's DragCon LA is an annual expo of drag culture held in Los Angeles billed as a convention that celebrates 'the art of drag, queer culture and self-expression for all', which debuted in 2015.[1] Its sister event is RuPaul's DragCon NYC started in 2017, and is considered the world's largest celebration of drag culture.[2] The event is an outgrowth of the internationally successful R...

Icelandic politician This is an Icelandic name. The last name is patronymic, not a family name; this person is referred to by the given name Þórdís. Þórdís Kolbrún R. GylfadóttirÞórdís in 2024Minister for Foreign AffairsIncumbentAssumed office 9 April 2024Prime MinisterBjarni BenediktssonPreceded byBjarni BenediktssonIn office28 November 2021 – 14 October 2023Prime MinisterKatrín JakobsdóttirPreceded byGuðlaugur Þór ÞórðarsonSucceeded byBjarni BenediktssonMin...

Sebuah perhitungan Indeks Pembangunan Manusia (IPM) yang menggunakan metode baru dilaksanakan oleh Badan Pusat Statistik (BPS) Jawa Timur dari tahun 2010 hingga sekarang. Berikut ini akan disajikan penjelasan, sejarah, dan metodologi perhitungan IPM, serta daftar kabupaten dan kota Jawa Timur menurut IPM tahun 2013. Penjelasan Indeks Pembangunan Manusia (IPM)/Human Development Index (HDI) adalah pengukuran perbandingan dari harapan hidup, melek huruf, pendidikan, dan standar hidup untuk semua...

Islam by countryWorld percentage of Muslims by country Africa Algeria Angola Benin Botswana Burkina Faso Burundi Cameroon Cape Verde Central African Republic Chad Comoros Democratic Republic of the Congo Republic of the Congo Djibouti Egypt Equatorial Guinea Eritrea Eswatini Ethiopia Gabon Gambia Ghana Guinea Guinea-Bissau Ivory Coast Kenya Lesotho Liberia Libya Madagascar Malawi Mali Mauritania Mauritius Mayotte Morocco Western Sahara Mozambique Namibia Niger Nigeria Réunion Rwanda São Tom...

Lega Nazionale B 1986-1987Lega Nazionale B Competizione Lega Nazionale B Sport Calcio Edizione 90ª Organizzatore Lega Nazionale Luogo Svizzera Partecipanti 16 Formula Un girone all'italiana Risultati Promozioni GrenchenLugano Retrocessioni BienneKriensOltenRenens Cronologia della competizione 1985-1986 1987-1988 Manuale La Lega Nazionale B 1986-1987, campionato svizzero di seconda serie, si concluse con la vittoria del FC Grenchen. Indice 1 Stagione 2 Classifica 3 Risultati 3.1 Tabellone 3....

Town in Scottish Borders, Scotland, UK This article is about the Scottish burgh. For other uses, see Peebles (disambiguation). Human settlement in ScotlandPeeblesScottish Gaelic: Na PùballanScots: PeeblesAn aerial view of PeeblesPeebles' Coat of ArmsPeeblesLocation within the Scottish BordersArea3.85 km2 (1.49 sq mi) [1]Population9,000 (2020)[2]• Density2,338/km2 (6,060/sq mi)OS grid referenceNT2540• Edinburgh21 mi (3...

Community with core principles of self-sufficiency Transition Town Witzenhausen The terms transition town, transition initiative and transition model refer to grassroot community projects that aim to increase self-sufficiency to reduce the potential effects of peak oil,[1] climate destruction, and economic instability[2] through renewed localization strategies, especially around food production and energy usage.[3] In 2006, the founding of Transition Town Totnes in the...

1824 hurricane affecting Devon and Dorset Fleet Old Church was destroyed in the storm but the chancel was retained. The Great Storm of 1824 (or Great Gale) was a hurricane force wind and storm surge that affected the south coast of England from 22 November 1824.[1] Nearly 100 people were believed to be killed.[2] At Sidmouth, low-lying houses along the Esplanade were inundated, and cottages at the exposed west end were destroyed. The 40 feet (12 m) sea-stack at Chit Rock ...

Gene Taylor und Blue Mitchell (Concertgebouw, 1959) Richard Allen „Blue“ Mitchell (* 13. März 1930 in Miami, Florida; † 21. Mai 1979 in Los Angeles, Kalifornien) war ein US-amerikanischer Jazz-Trompeter und Komponist. Inhaltsverzeichnis 1 Leben und Werk 2 Diskografie 2.1 Als Bandleader 2.2 Als Begleitmusiker/Sideman 3 Literatur 4 Weblinks 4.1 Radiofeature 4.2 Musikbeispiele 5 Einzelnachweise Leben und Werk Am Beginn seiner Musikerlaufbahn arbeitete Blue Mitchell bei Paul Williams 1951 ...

1958 1967 Élections législatives de 1962 dans l'Isère 7 sièges de députés à l'Assemblée nationale 18 et 25 novembre 1962 Corps électoral et résultats Inscrits 399 859 Votants au 1er tour 246 775 61,72 % 10,3 Votes exprimés au 1er tour 241 338 Votants au 2d tour 268 702 67,2 % Votes exprimés au 2d tour 260 803 Majorité présidentielle Liste Union pour la nouvelle République (UDT)Républicains indépendantsModérés Voix ...













![{\displaystyle \mathrm {OF_{2}+H_{2}O{\xrightarrow[{OH^{-}}]{\triangle }}2HF+O_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/47cb9c434419f8559b748226d8f0cf3a04220891)

