| Chlorid antimonitû§ |
|---|
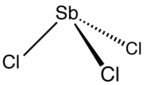 StrukturnûÙ vzorec |
 Kuliákovû§ model |
| Obecnûˋ |
|---|
| Systematickû§ nûÀzev | chlorid antimonitû§ |
|---|
| Anglickû§ nûÀzev | Antimony trichloride |
|---|
| Námeckû§ nûÀzev | Antimon(III)-chlorid |
|---|
| SumûÀrnûÙ vzorec | SbCl3 |
|---|
| Vzhled | bezbarvûÀ pevnûÀ lûÀtka |
|---|
| Identifikace |
|---|
| RegistraánûÙ áûÙslo CAS | 10025-91-9 |
|---|
| PubChem | 24814 |
|---|
| SMILES | Cl[Sb](Cl)Cl |
|---|
| InChI | InChI=1S/3ClH.Sb/h3*1H;/q;;;+3/p-3 |
|---|
| áûÙslo RTECS | CC4900000 |
|---|
| Vlastnosti |
|---|
| MolûÀrnûÙ hmotnost | 228,11 g/mol |
|---|
| Teplota tûÀnûÙ | 73,4 ô¯C |
|---|
| Teplota varu | 223,5 ô¯C |
|---|
| Hustota | 3,14 g/cm3 |
|---|
| Index lomu | 1,46 |
|---|
| Rozpustnost ve vodá | 601,1 g/100 ml (0 ô¯C)
985,1 g/100 ml (25 ô¯C)
1357 g/100 ml (40 ô¯C) |
|---|
Rozpustnost v polûÀrnûÙch
rozpouéÀtádlech | alkoholy, dichlormethan, ether, dioxan |
|---|
Rozpustnost v nepolûÀrnûÙch
rozpouéÀtádlech | tetrachlormethan |
|---|
| Bezpeánost |
|---|
 GHS05 GHS05 GHS09 GHS09
NebezpeáûÙ[1] |
| NFPA 704 | |
|---|
NenûÙ-li uvedeno jinak, jsou pouéƒity jednotky SI a STP (25 ô¯C, 100 kPa).
|
Chlorid antimonitû§ je anorganickûÀ slouáenina s vzorcem SbCl3. JednûÀ se o bezbarvou tuhou lûÀtku, kterûÀ je silná hygroskopickûÀ.
PéûÙprava
Chlorid antimonitû§ lze péipravit reakcûÙ antimonu, bromidu antimonitûˋho, oxidu antimonitûˋho nebo sulfidu antimonitûˋho s chlorem. Takûˋ ho lze péipravit reakcûÙ koncentrovanûˋ kyseliny chlorovodûÙkovûˋ s oxidem antimonitû§m.
Reakce
SbCl3 hydrolyzuje péi styku se vzduéÀnou vlhkostûÙ, proto je nutnûˋ jej péechovûÀvat v inertnûÙ atmosfûˋée. ReakcûÙ s malû§m mnoéƒstvûÙm vody vznikûÀ chlorid-oxid antimonitû§ a uvoléuje se chlorovodûÙk.
- SbCl3 + H2O ã SbOCl + 2 HCl
S vátéÀûÙm mnoéƒstvûÙm vody vznikûÀ Sb4O5Cl2, kterû§ zahéûÙvûÀnûÙm v atmosfûˋée argonu péechûÀzûÙ na Sb8O11Cl12.[2]
VyuéƒitûÙ
SbCl3 se vyuéƒûÙvûÀ k dé₤kazovûˋ reakci pro vitamûÙn A a podobnûˋ karotenoidy, s kterû§mi poskytuje modrû§ komplex. Ten lze stanovit kolorimetricky.
Odkazy
Reference
V tomto álûÀnku byl pouéƒit péeklad textu z álûÀnku Antimony trichloride na anglickûˋ Wikipedii.
- ã a b Antimony trichloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupnûˋ online. (anglicky)
- ã N. N. Greenwood ã A. Earnshaw, Chemie prvké₤ 1. dûÙl, 1. vydûÀnûÙ 1993, s. 698 ISBN 80-85427-38-9
ExternûÙ odkazy