医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(いやくひん いりょうききとうのひんしつ ゆうこうせいおよびあんぜんせいのかくほとうにかんするほうりつ、昭和35年8月10日法律第145号、英語: Act on Securing Quality, Efficacy and Safety of Products Including Pharmaceuticals and Medical Devices)は、日本における医薬品、医薬部外品、化粧品、医療機器および再生医療等製品に関する運用などに関する法律である。医薬品医療機器等法、薬機法(やくきほう、やっきほう)と略される。制定当初の題名は「薬事法」(やくじほう、英語: Pharmaceutical Affairs Law)であったが、平成26年11月25日の薬事法等の一部を改正する法律(平成25年法律第84号)の施行により現在の題名に改められた。 目的は、第1条にあり、この趣旨に基づき、行政の承認や確認、許可、監督等のもとでなければ、医薬品や医薬部外品、化粧品、医療機器の製造や輸入、調剤で営業してはならないよう定めている。 主務官庁構成
定義医薬品(2条1項)
毒薬 毒薬は医薬品の一種である。定義及び取扱いは同法44条以下が定めている。 毒性が強い医薬品を薬事・食品衛生審議会の意見を聴いて厚生労働大臣が毒薬として法令で指定する。毒薬は黒地に白枠、白字をもって、その品名及び「毒」の文字が記載されていなければならない。また、その保管に際しては、施錠できる場所に他の物と区別して貯蔵および陳列しなければならない。 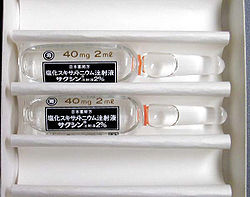 具体的には、急性毒性における致死量(半数致死用量・LD50。その量を投与されると半数が死ぬ量のこと。後述「劇薬」においても同定義)が、経口投与で体重1kgあたり50mg以下のものを言う。 毒物及び劇物取締法により定義される毒物としばしば混同されるが、全くの別定義である。毒物及び劇物取締法2条により、医薬品としての毒薬は毒物ではない。医薬用でない毒物は、「医薬用外毒物」の表示がなされる。本法で定義される毒薬はあくまで医薬品のカテゴリーの一つであり、疾患の治療や検査に用いられる薬で、他の医薬品と同様、適切に使用すれば、安全で有用な薬である。 例としてジギトキシン(強心薬)、塩酸モルヒネ末(麻薬性鎮痛薬)、アムホテリシンB(抗真菌薬) など 劇薬 劇薬は医薬品の一種である。定義及び取扱いは同法44条以下が定めている。 劇性が強いものを薬事・食品衛生審議会の意見を聴いて厚生労働大臣が劇薬として法令で指定する。劇薬は白地に赤枠、赤字をもって、その品名及び「劇」の文字が記載されていなければならない。また、その保管に際しては、他の物と区別して貯蔵および陳列しなければならない。 具体的には、致死量が、経口投与で体重1kgあたり300mg以下、皮下注射で体重1kgあたり200mg以下のものを言う。 前述の毒物と同様、毒物及び劇物取締法により定義される劇物とは別定義である。毒物及び劇物取締法2条2項により、医薬品としての劇薬は劇物ではない。医薬用でない劇物は、「医薬用外劇物」の表示がなされる。ただしジクロルボスのように同じ有効成分でも、製剤の形態で劇薬と劇物に分かれるものもあるが、同一製剤が劇薬と劇物両方に指定されることはない。 例として、ハロタン(吸入麻酔薬)、トルブタミド(経口糖尿病薬)、大半の向精神薬など 普通薬毒薬、劇薬以外の医薬品であり、ラベルの表示や保管方法の特定の取り決めなし アスピリン(解熱鎮痛剤)、フロセミド(利尿薬)など 習慣性医薬品習慣性医薬品は、1961年から旧薬事法の第50条第9号にて指定されている。国際的な睡眠薬の乱用に伴って処方薬とすべきことが決定された医薬品である[1]。後に麻薬及び向精神薬取締法による指定が追加されることになる。 医薬部外品医薬部外品は、同法2条2項が定義する物である。人体に対する作用が緩和なものであり、医薬品のように販売業の許可を必要とせず、一般小売店において販売することができる。
化粧品化粧品は、同法2条3項で定義されている。 人体を清潔にし、美化し、魅力を増し、容貌を変え、または皮膚や毛髪等を健やかに保つために、皮膚または毛髪に塗擦、散布などされる物で、人体に対する作用の緩和なもの(医薬品、医薬部外品の効能効果を持つものを除く) 医療機器医療機器は、同法2条4項で定義されている。 ヒトまたは動物の疾病の診断、治療又は予防を目的とし、ヒトまたは動物の構造・機能に影響を及ぼすことが目的とされている機械器具(再生医療等製品を除く)で、政令で定めるもの。 機械器具ではなく単体のソフトウェアであっても、ヘルスソフトウェアと呼ばれるソフトウェアについては、医療機器として取り扱う。ヘルスソフトウェアとは、疾病診断用プログラム、疾病治療用プログラム、疾病予防用プログラム、および、それらを記録した記録媒体である。それらの中でも、副作用又は機能の障害が生じた場合に人の生命及び健康に影響を与えるおそれがあるものについては、他の医療機器同様に製造・販売が規制される(23条の2関係、39条関係)。なお、これらを電気通信回線を通じて提供を行う場合、医療機器販売業として取り扱われる。 その他の定義
医薬品、医薬部外品、化粧品、医療機器の取扱い添付文書医薬品および医療機器は、原則として、当該製品に、警告、禁忌、禁止、使用上の注意、品目仕様、操作方法、包装単位などを記載した文書を添付しなければならない。これを「添付文書」という。 表示医薬品、医薬部外品、化粧品、医療機器には、その容器、包装もしくは直接の被包に、製造販売業者の氏名または名称および住所、名称、製造番号または製造記号など、法で定められた事項を記載する義務がある。 広告規制医薬品、医薬部外品、化粧品、医療機器については、虚偽または誇大な記事を広告し、記述し、または流布してはならない(66条)。具体的な基準としては、医薬品等適正広告基準(平成29年9月29日薬生発0929第4号厚生労働省医薬・生活衛生局長通知)があり、同通知によると、例えば、承認や認証を要する医薬品等については、その承認または認証を受けた範囲を超えた効能効果等を標榜することはできない。 広告に該当するかどうかについては次の3つの要件があり、すべてを満たした場合に広告に該当する。
調剤された薬剤に関する情報提供及び指導等薬局開設者は薬剤師に書面を用いて必要な情報を提供させ、必要な薬学的知見に基づく指導を行わせなければならない。 薬局開設者は薬剤師に当該薬剤を使用しようとする者の年齢、他の薬剤または医薬品の使用の状況その他の厚生労働省令で定める事項を確認させなければならない。 薬局開設者は、前述の情報の提供または指導ができないとき、その他規定する薬剤の適正な使用を確保することができないと認められるときは、当該薬剤を販売し、または授与してはならない。(9条) 許認可許可製造販売や製造、特定のものの販売を行うためには、許可が必要である。
認定日本国内で上市する医薬品、医薬部外品、医療機器の日本国外の製造施設は、外国製造業者認定を取得する必要がある。 承認等日本国内で上市する医薬品及び医薬部外品は、製造販売承認を取得しなければならない。化粧品については製造販売届の提出が必要である。 医療機器については、高度管理医療機器及び指定管理医療機器以外の管理医療機器については製造販売承認を、管理医療機器については製造販売認証を取得しなければならない。一般的名称の定められている既存の一般医療機器については製造販売届の提出が必要である。 省令
責任者、管理者
資格歴史および薬事法改正→「薬事法の歴史」を参照
各国の薬事規制法令→詳細は「医療品規制」を参照
脚注注釈
出典
関連項目関係法令規制対象
医療品規制関連 |
||||||||||||||||||||||||||||||||||||














