|
プルトニウム
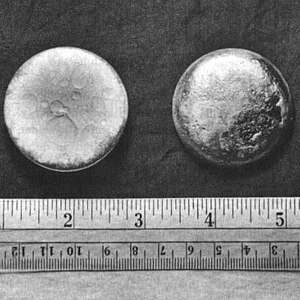
プルトニウム(英・羅: Plutonium 英語: [pluːˈtoʊniəm])は、原子番号94の元素である。元素記号は Pu。アクチノイド元素の一つ。 名称原子番号92のウラン、93のネプツニウムがそれぞれ太陽系の惑星の天王星、海王星に因んで命名されていたため、これに倣って当時海王星の次の惑星と考えられていた冥王星 pluto から命名された。発見者のグレン・シーボーグは冗談で元素記号に Pu を選んだ。子供が臭いときに叫ぶPee-Yoo!を連想するからだが[3]、特に問題にならずに周期表に採用された。 表記ゆれ概要ウラン鉱石中にわずかに含まれていることが知られる以前は、完全な人工元素と考えられていた。超ウラン元素で、放射性元素である。プルトニウム239、プルトニウム241その他いくつかの同位体が存在している。半減期はプルトニウム239の場合約2万4000年(α崩壊による)。比重は19.8で、金属プルトニウムは、ニッケルに似た銀白色の光沢を持つ大変重い金属である(結晶構造は単斜晶)。融点は639.5 °C、沸点は3230 °C(沸点は若干異なる実験値あり)。硝酸や濃硫酸には酸化被膜ができ、溶けない。塩酸や希硫酸などには溶ける。原子価は+3〜+6価(+4価が最も安定)。金属プルトニウムは、特に粉末状態において自然発火することがある。塊の状態でも、湿気を含む大気中では自然発火することがあり、火災の原因となる。プルトニウムとその化合物の化学的な毒性は、他の一般的な重金属と同程度である[6]。またプルトニウムは放射性崩壊によってα線を放出するため、ヒトを含む動物の体内、特に肺に蓄積されると強い発癌性を示すとされている。 原子炉において、ウラン238が中性子を捕獲してウラン239となり、それがβ崩壊してネプツニウム239になり、さらにそれがβ崩壊してプルトニウム239ができる(原子炉内では他のプルトニウム同位体も多数できる)。ウラン238は天然に存在するのでネプツニウム239とプルトニウム239は微量ながら天然にも存在する。また半減期が約8000万年とプルトニウム同位体の中では最も長いプルトニウム244も微量ながら天然に存在する。なお、プルトニウム239およびプルトニウム240とそれらの放射壊変物の飛沫の吸引は 世界保健機関(WHO)の下部機関IARCにより「発癌性がある」(Type1)と勧告されている。 プルトニウムは主に核兵器の原料や、プルサーマル原子力発電におけるMOX燃料として使用される。人工衛星の電源として原子力電池として使用されたこともある。核テロリズム・原子力事故防止のため、プルトニウムの所在は国際機関や各国政府により厳しく監視・管理されている。日本は2020年末時点で、英仏への再処理委託により生じた分を含めて国内に約8.9トン、海外に約37.2トン、合計で約46.1トンのプルトニウム(うち核分裂性は約30.5トン)を保有している[7]。 特性金属プルトニウムは銀白色であるが、酸化されると黄褐色となる。金属プルトニウムは温度が上がると収縮する。また、結晶構造の対称性が低いため、時間経過と共に脆くなる。  註:プルトニウム塩水溶液の色は、酸化数だけでなく配位する陰イオンの種類にも依存する。
利用同位体 239Pu は、核分裂を起こしやすく生成も容易なため、現代の核兵器における主要な核分裂性物質である。球状プルトニウムの臨界量は16 kgだが、中性子反射体で製作したタンパーを用いて中心方向に中性子を反射させることで10 kg(直径10 cmの球に相当)まで減らすことができる。1 kgのプルトニウムが完全に反応したとすると、20キロトンの TNT 相当の爆発エネルギーを生むことができる。 239Pu はα崩壊により 235U を生成する。235U も核分裂を起こしやすいが、親核種の 239Pu はより核分裂を起こしやすい。また、239Pu はアクチニウム系列に含まれている。 同位体 238Pu は半減期87年でα崩壊により発熱する。このため熱電変換器と組み合わせた原子力電池とすることで、人間の寿命程度のタイムスケールにおいて保守なしで機能し続ける必要がある機器の電源として利用することができる。実際に、宇宙探査機ガリレオやカッシーニの電源となる同位体電池にも用いられている。また、同様の技術が、アポロ月面探査計画における地震実験にも用いられている。 238Pu は植え込み型心臓ペースメーカーの電源にも用いられ、電池交換のために手術を繰り返すリスクを避けるのに役立っていた。近年ではほとんどが一次電池であるヨウ化リチウムを用いているが、2003年時点では50から100個程度のプルトニウム電源のペースメーカーが患者に埋め込まれている[要出典]。ただし、日本国内ではプルトニウム電源のペースメーカーは使用はもちろんのこと、製造も禁止されている。日本では放射性同位体の規制に抵触するからである。 天然での存在大部分のプルトニウムは、人工的に生成されたものであるが、天然においては、ごく微量のプルトニウムが、ウラン鉱石中に存在する。これは、238U が中性子捕獲により 239U になり、その後2回のβ崩壊により 239Pu に変化するためである。この過程は原子炉におけるプルトニウムの生成と同じ反応である。その後は 239Pu → 235U → 231Th → 231Pa と崩壊していき、最終的には207Pbになる。この発見は1952年のことで、結果、ウランに代わって地球上に天然に存在する最も原子番号の大きな元素となった(その前年にはネプツニウムが天然において発見された)。 →詳細は「アクチニウム系列」を参照
また、太陽系の誕生以前の超新星爆発で生成された 244Pu が痕跡量ではあるが現在も残っている。これは、244Puの半減期が8千万年と相当に長いからである。ただし、天然においてはプルトニウムの同位体は本当に微量しか存在しない。あくまでウランが宇宙線などが原因で発生する中性子線を吸収した結果、生じているに過ぎず、地球誕生時にプルトニウムが存在していたとしても、ウランよりも半減期が短いため、現在まで存在し続けることは通常ならできないと考えられている。 1972年に、ガボン共和国にあるオクロの天然原子炉で、比較的高濃度の天然プルトニウムが発見された。 環境中のプルトニウムは、ほとんど酸化プルトニウム(IV) (PuO2) の形で存在しているが、これは非常に水に溶けにくい[8]。1000万立方メートルの純水に、プルトニウム原子1個が溶ける程度であるといわれている。 化合物プルトニウムは酸素と容易に反応し、PuO, PuO2 となる。いったん高温で焼き締めた PuO2 は硝酸にも難溶となるが、フッ化水素酸を加えると溶ける[9]。また、その中間の酸化物も生成する。また、ハロゲンとも反応し、PuX3 の形の化合物を作る。PuF4 および PuF6 も見られる。PuOCl, PuOBr および PuOI のようなハロゲン化酸化物も確認されている。 炭素と反応して PuC、窒素と反応して PuN、またケイ素と反応して PuSi2 を形成する。プルトニウムは他のアクチノイド元素と同様、酸化プルトニウム(IV) PuO2 を形成するが、自然環境中では炭酸など酸素を含むイオン(OH− 強い硝酸酸性溶液を中和して作った PuO2 は、錯体にならない PuO2 重合体を生成しやすい。プルトニウムはまた価数が+3〜+6価の間で変化しやすい。ある溶液のなかでこれら全ての価数で平衡して存在することも珍しくない。 同素体→詳細は「プルトニウムの同素体」を参照
常圧下でもプルトニウムは6種の同素体を持ち、それぞれ結晶構造や密度が大きく異なる。密度は最大のα相と最小のδ相では25 %以上も違う。特に、δ相は負の熱膨張を起こすという特異的性質を持つ[10]。
様々な同素体を持つということが、プルトニウムの機械加工を非常に難しいものにしている。加工時に加わる熱や圧力によって、相が非常に容易に変わってしまうからである。このような複雑な相変化をする原因は完全には解明されていない。最近の研究では、相変化の精密なコンピュータモデルが着目されている。 兵器への利用においては、相の安定性を増し加工性と取り扱いを容易にする目的で、他の金属と合金にして用いられる(数%のガリウムを加えるなど。「プルトニウムガリウム合金」参照)。核兵器においては、プルトニウムのコアを爆縮するための衝撃波も相変化の原因になる。この場合には通常のδ相からより密度の高いα相に変化するので、超臨界状態[注釈 1]を実現するのに大いに助けになる。 同位体とその利用特性→詳細は「プルトニウムの同位体」を参照
人類の利用の観点で重要な同位体は 239Pu(核兵器と原子炉燃料に適)および 238Pu(原子力電池に適)である。これらは遅発中性子による臨界制御が可能である。一方、同位体 240Pu は 239Pu の中性子捕獲により生成するが、この核種は非常に容易に自発核分裂を起こす。このため 240Pu は核兵器で使用されるプルトニウムにおいて不純物として重要である。240Pu は自発核分裂により中性子をランダムに放出するため、計画した瞬間に正確に連鎖反応を開始させるような制御ができない。つまり爆弾の信頼度および出力を減少させてしまう。 核兵器原料としてのプルトニウムプルトニウムを生産する際に239Pu のみ生成させることはできず、必ず複数の同位体が混在してしまう。前述の通り 240Pu は極めて容易に自発核分裂を起こすが、核兵器において 240Pu が一定量以上存在すると、自発核分裂により核兵器の内部に設計よりも早く核分裂連鎖反応が始まる部分が生じ、そのエネルギーでプルトニウム全体が核分裂を始める前にばらばらに吹き飛んでしまう(過早爆発)。爆縮レンズを用いたインプロージョン型核兵器では 240Pu が10 %程度以上混入すると過早爆発となるが、ガンバレル型の場合は 240Pu が1 %前後混入しただけで過早爆発が起きる。このため、プルトニウムを用いる核兵器ではインプロージョン型設計の採用が必須となる。実際に、第二次世界大戦中のアメリカ合衆国による原子爆弾開発(マンハッタン計画)では、ガンバレル型プルトニウム原爆シンマンも設計されていたが、過早爆発を防ぐのは困難として開発が中止されている。結局、核兵器原料とするプルトニウムは 240Pu の含有量を10 %以下とする必要があるが、これは軽水炉では実現困難なため黒鉛炉を使用して生産される。 240Pu の混入という課題は核兵器開発において2つの側面を持つ。一つは混入による過早爆発対策として爆縮レンズ技術を開発する必要が生じ、マンハッタン計画に遅れと障害をもたらしたこと、もう一つは爆縮レンズ技術自体が極めて高度な技術であり、容易に獲得できるものではないため、他国の核開発における技術障壁になったことである。なお 239Pu の同位対比が約90 %を越えるプルトニウムは兵器級プルトニウムと呼ばれる。アメリカ国内で生産された兵器級プルトニウムは、工場によりプルトニウムの同位体比が下表のようになっていた[13]。
原子炉一般的な商用原子炉である軽水炉から得られたプルトニウムは少なくとも20%の 240Pu を含んでおり、原子炉級プルトニウムと呼ばれる[14]。 原子炉級プルトニウムでも核兵器の製造は可能であるが[15][16]、不安定な原子炉級プルトニウムでは爆発装置の製造が兵器級プルトニウムに比べて困難であり、兵器としての信頼性にも欠けるため、通常は核兵器に用いられることはない。だが、原子炉級プルトニウムを高速増殖炉(日本には「常陽」「もんじゅ」がある)に装荷して原子炉の運転をすると、その炉心の周囲にあるブランケットという部分で高純度の兵器級プルトニウムが生産できる。これまでに「常陽」のブランケットには 239Pu 同位体純度99.36%のプルトニウムが22kg、「もんじゅ」のブランケットには97.5%のプルトニウムが62kg生成されている。これを再処理工場で取り出すだけで原子爆弾30発以上を製造できる量になるとの主張もある[17]。 原子力電池プルトニウムの同位体の一つであるプルトニウム238は半減期が約84年と非常に短く、その分単位時間あたりの崩壊熱が非常に大きい。そのため温度勾配を利用した熱電発電用の発熱体として利用することで、電源として利用することができる。宇宙探査機や寒冷地の灯台用の電源として利用される。 毒性1945年以来、約10トンのプルトニウムが、核実験を通じて地球上に放出された。核実験による放射性降下物のため、既に世界中の人体中に1–2 pCi (0.037–0.074 Bq) のプルトニウムが含まれている[18]。また、核実験由来のプルトニウムが地表面の土壌に0.01–0.1 pCi/g (0.37–3.7 Bq/kg) 存在する[19]。このほか、原子力施設などの事故や、再処理工場からの排出[20]により、局地的な汚染が存在する。 プルトニウムの同位体は全て放射性である。このため、単体の金属プルトニウムならびにプルトニウム化合物は全て放射性物質である。化学毒性についてはウランに準ずると考えられている[21]。しかし、その化学毒性が現れるよりもはるかに少ない量で放射線障害が生じると予想されるため、化学毒性のみでプルトニウムの毒性を論ずることはできない[22][23]。 プルトニウムの急性毒性による半数致死量は経口摂取で32 g、吸入摂取で13 mg[23][24]。長期的影響の観点では経口摂取で1150 mg、吸入摂取で0.26 mg(潜伏期間として15年以上)[25][26]である。また、プルトニウム239の年摂取限度(1 mSv/年)は、経口摂取で48 μg(11万 Bq)、呼吸器への吸入では52 ng (120 Bq) である[27]。プルトニウムは人類が初めて作り出した人工核種である[27]。小出裕章は、α線源であるため放射線荷重係数が大きいこと、同じα線源である天然核種のウランなどと比べ半減期が短いため比放射能が高いこと、体内での代謝挙動(肺での不均等被曝は、発癌性が極端に高くなる)の3点から「かつて人類が遭遇した物質のうちでも最高の毒性をもつ」と報告している[27]。プルトニウムの有害性は、体内に取り込んだ場合の内部被曝には特に留意すべきである。 プルトニウムは人体に全く不要な元素である[28]。ヒ素やセレンのようにプルトニウムと同程度の毒性を持ちながら生物学的役割も持つ必須元素も存在するがプルトニウムはヒ素やセレンと異なり生物学的役割は何一つなく必須元素ではない[28]。 体内摂取の経路と排出プルトニウムを嚥下して消化管に入った場合、そのおよそ0.05 %程度が吸収され、残りは排泄される[8]。吸収された微量のプルトニウムは骨と肝臓にほぼ半々の割合で蓄積され、体外へは排出されにくい。生物学的半減期(体内総量が当初の半分になるまでの期間)はウランやラジウムと比べても非常に長く、一説には骨に50年程度、肝臓に20年程度といわれる[29][30]。放射線有害性は全てのα線源核種と同じであり、Pu のみが特別というものではない。 最も有害な取り込み経路は、空気中に浮遊するプルトニウム化合物粒子の吸入である。気道から吸入された微粒子は、大部分が気道の粘液によって食道へ送り出されるが、残り(4分の1程度)が肺に沈着する。沈着した粒子は肺に留まるか、胸のリンパ節に取り込まれるか、あるいは血管を経由して骨と肝臓に沈着する[25][26]。そのため、他のα線・β線放射物質による内部被曝と同様に、国際がん研究機関(IARC)より発癌性があると (Type1) 勧告されている。また、動物実験では発癌性が認められているが、人においてはプルトニウムが原因で発癌したと科学的に判断された例はまだない[23]。α線源であるため、国際放射線防護委員会(ICRP)が定める線量係数[31][32]では 239Pu の経口摂取で2.5×107、吸入摂取で1.2×10−4 と定められ、131I(経口摂取2.2×10−8)や 137Cs(経口摂取1.3×10−8)よりも1 Bq当たりの人体への影響が大きいと想定されている(一般には、α線はβ線よりも20倍の危険性があるとされている)。 長期内部被曝の通説に疑義を呈する資料ATOMICA によると、米国での1974年までのデータとして、最大許容身体負荷量 (1.5kBq) の10–50 %摂取した例が1155例、同50 %以上が158例ある。このうち代表的な2例(世界大戦における原爆製造工場、冷戦期の兵器工場火災でのPu含有ガス吸引)において、24年経過後で肺ガン「致死」は1名、42年経過後の「発症」では肺ガン3例と骨肉腫1例であった。これは被曝のない通常のグループよりも発生率が低い。ただ発症までの潜伏期が40–50年と長年であり、調査対象者も高齢化しており、疑わしい疾病を発症してもプルトニウムを病原と断定しにくいのも事実である[26][33][34]。 臨界管理 プルトニウム239の臨界量は、金属の場合、ウラン235の4分の1しかないため[35]、臨界量に近い量のプルトニウムが蓄積しないように注意しなければならない。すなわち形状が重要で、球体のようなコンパクトな形にしてはならないのである。溶液状のプルトニウムは固体より少ない量で臨界量に達する。それが単に溶けるか破片になるのではなく爆発するためには超臨界を大きく越える量を必要とするので、兵器級の核爆発は偶然に生じることはありえない。しかし、ひとたび臨界量に達すれば致死量の放射線が発生する。 臨界事故は過去に何度か起きており、それらのうちのいくつかで死者を出している。核開発の草創期の事故として著名なのが、いわゆる「デーモン・コア」の事例である。1945年8月21日、米国ロスアラモス国立研究所で致死量の放射線を発生させた事故は、6.2 kgの球状プルトニウムを囲んだ炭化タングステンブロックの不注意な取り扱いに起因していた。このとき科学者ハリー・ダリアンは推定510 rem (5.1 Sv) の被曝をし4週間後に死亡した。その9か月後に、別のロスアラモスの科学者ルイス・スローティンは、ベリリウムの反射材、および以前にダリアンの生命を奪ったのとまさに同じプルトニウムコアによる同様の事故で死亡した。2人の科学者の命を奪ったプルトニウムコアは「デーモン・コア」と名づけられた。これらの出来事は、1989年の映画『シャドー・メーカーズ』でかなり正確に描写された。1958年には、ロスアラモスのプルトニウム精製工程で、混合容器の中で臨界量が形成され、クレーン操作員が死亡した。この種の事故が、ソ連等の国で起こった(詳しくは「原子力事故」参照)。1986年にソ連で起きたチェルノブイリ原子力発電所事故は、大量のプルトニウムの放出を引き起こした。 さらには、金属プルトニウムには発火の危険がある。特に素材が微粒子に分割されている場合が危険である。金属プルトニウムは酸素および水と反応し、自然発火性物質である水素化プルトニウムが蓄積する可能性があり、室温の空気中で発火しうる。プルトニウムが酸化してその容器を壊すとともに、プルトニウムが相当に拡散する。燃えている物質の放射能は危険性が増す。酸化マグネシウムの砂は、プルトニウム火災を消火するための最も有効な素材である。それはヒートシンクとして働き燃えている物質を冷やし、同時に酸素を遮断する。 1969年に米国コロラド州ボルダーの近くにあるロッキーフラッツ工場でプルトニウムが主な発火源になった火災があった[36]。これらの問題を回避するために、どんな形態であれプルトニウムを保管・取り扱う場合は特別の警戒が必要である。一般的に、乾燥した不活性ガスが必要である[37]。 余剰兵器の解体で発生するプルトニウムラジウムあるいは炭素14のような自然に生じる放射性同位体とは対照的に、プルトニウムは冷戦中に核兵器製造のために大量に(数百トン)濃縮・製造・分離されたことは注目すべきである。1944年から1994年までの期間にアメリカ合衆国だけで110トンのプルトニウムを分離し、今なお100トンを保有している。化学兵器、生物兵器と異なり、化学過程ではそれらを破壊することができないので、これらの備蓄は、武器形式であるかどうかに関わらず重大な問題を提起する。余剰の兵器級プルトニウムを処分する1つの提案はそれを高レベルの放射性同位体(例えば使用済み原子炉燃料)と混合することである。こうして潜在的な盗取、あるいはテロリストによる取り扱いを防止する。別の手段としては、ウランとそれを混合し原子炉用燃料(混合酸化物すなわちMOXアプローチ)として消費することである。これは 239Pu の多くを核分裂により破壊するだけでなく、残りのかなりの部分を核兵器としては役立たない 240Pu およびより重い同位体に変化させることができる[18]。 規制日本では、プルトニウムの全ての同位体は 核原料物質、核燃料物質及び原子炉の規制に関する法律 で、その保管、取り扱いを規制されているとともに、外国為替法の中で国際規制物資として輸出入が規制されている。 歴史最初はウォルター・ラッセルによって存在が予想されていたが、ウラン238に中性子を照射してプルトニウムとネプツニウムを合成することは、1940年に2つのチームが互いに独立に予想した。米国カリフォルニア大学バークレー放射線研究所のエドウィン・M・マクミランとフィリップ・アベルソン、そして英国ケンブリッジ大学キャベンディッシュ研究所のノーマン・フェザーとイーゴン・ブレッチャーだった。偶然にも、両チームともが、外惑星の並びに似せて、ウランに続く同じ名前を提案していた。 最初に合成・分離したのは1941年2月23日、米国の化学者グレン・セオドア・シーボーグ、エドウィン・M・マクミラン、J・W・ケネディー、およびA・C・ワールで、バークレーの60インチサイクロトロンを使ってウランに重水素を衝突させる方法によってプルトニウム238が合成された。この発見は戦時下だったため秘匿された。マンハッタン計画において、最初のプルトニウム生産炉がオークリッジに建設された。後にプルトニウム生産のための大型炉がワシントン州ハンフォードに建造されたが、このプルトニウムは最初の原子爆弾に使用され、ニューメキシコ州ホワイトサンズのトリニティ実験場で核実験に使われた。また、ここのプルトニウムがプルトニウムの発見からわずか5年後、第二次世界大戦末の1945年、原子爆弾ファットマンとして長崎市に投下された。この時のプルトニウムは、使用済みウラン燃料を処理し、リン酸ビスマス・三フッ化ランタンと共沈させることでウラン及び放射性アクチノイド同位体を除去するリン酸ビスマス法(Bismuth phosphate process)により精製することで得られたが、戦後はPUREX法に取って代わられた。 冷戦時代を通じて、ソビエト連邦とアメリカ合衆国の双方で厖大な量のプルトニウムの備蓄が行われた。1982年までに推定300トンのプルトニウムが蓄積された。冷戦の終了とともに、こうしたプルトニウムの備蓄が、核拡散の恐れの焦点となった。2002年にアメリカ合衆国エネルギー省は、アメリカ合衆国国防総省から34トンの余剰の兵器級プルトニウムの所有権を譲り受けた。2003年初頭の時点で、合衆国内にあるいくつかの原子力発電所において、プルトニウムの在庫を焼却する手段として濃縮ウラン燃料からMOX燃料へ転換することが検討されている。 プルトニウムが発見されてから数年の間、その生物学的・物理的特性はほとんど知られていなかった。そこで、合衆国政府およびその代理として活動する私的組織によって一連の放射線人体実験が行われた。第二次世界大戦の間から戦後にわたり、マンハッタン計画やその他の核兵器研究プロジェクトに従事した科学者が、実験動物や人体へのプルトニウムの影響を調べる研究を行った。人体に関しては、末期患者あるいは高齢や慢性病のため余命10年未満の入院患者に対し、(典型的には)5 μgのプルトニウムを含む溶液を注射することにより実施された。この注射は、こうした患者へのインフォームド・コンセントなしに行われた[38]。 脚注出典
注釈関連項目外部リンク
Information related to プルトニウム |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||