氯化铋化学式BiCl3,常温下是易潮解的白色晶体。与离子晶体三氟化铋不同,在气相或晶体中,氯化铋分子构型都为三角锥形,可从价层电子对互斥理论(VSEPR)解释。是常用的提供Bi3+离子的试剂。氯化铋是常用的提供Bi3+离子的试剂,以及用于制备其它铋盐,以用于颜料和化妆品。
制备
氯化铋可从氯气与铋直接反应制得:
- 2 Bi + 3 Cl2 → 2 BiCl3
或用盐酸溶解氧化铋:
- Bi2O3 + 6 HCl → 2 BiCl3 + 3 H2O
或将氧化铋溶于浓硝酸,再向溶液中加入氯化钠固体:[1]
- Bi + 6 HNO3 → Bi(NO3)3 + 3 H2O + 3 NO2
- Bi(NO3)3 + 3 NaCl → BiCl3 + 3 NaNO3
化学性质
氯化铋易水解,生成氯氧化铋:[2]
- Bi3+
+ Cl−
+ H
2O → BiOCl (s) + 2 H+
故配制Bi³⁺离子的溶液需要加酸抑制其水解。[3]
氯化铋是一种氧化剂,遇还原剂如氯化亚锡生成黑色的金属铋粉末,此反应可用于检验Bi³⁺。
氯配合物
氯化铋作为一种路易斯酸,在Cl-浓度高的溶液中能形成各种氯配合物,如BiCl63−。其八面体结构与价层电子对互斥理论的判断不符, 不过BiCl52−的四方锥结构符合该理论的判断。[4]
 |
 |
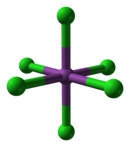
|
| Cs3[BiCl6] |
Cs3[BiCl6] |
[BiCl6]3−
|
有机反应催化剂
氯化铋用于有机合成的催化剂,例如麦克尔加成反应,碘的加入能提高催化效率。[5]
安全性
氯化铋有毒,能刺激胃肠道和呼吸道,与皮肤接触可能导致灼伤。
参考资料