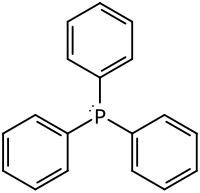
Triphenylphosphan
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

منظمة الأمن والتعاون في أوروباالشعارالعلمالتاريخالتأسيس 1975 المدراء إيفيتسا داتشيتش (2015 – )هيلغا شميد (2020 – ) عوضت اتفاقية هلسنكي الجوائز جائزة إيوالد فون كلايست (2015) emperor Otto award (en) الإطارالاختصار القائمة ... OSCE (بالفرنسية)OSCE (بالإنجليزية)ОБСЕ (بالروسية)OSZE (بالألماني...

This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Lippisch P.15 – news · newspapers · books · scholar · JSTOR (February 2024) (Learn how and when to remove this template message) P.15 Model of the Li P.15 Diana Role FighterType of aircraft National origin Germany Manufacturer Lippisch Designer Alexander Lippis...

Soil classification process Soil survey, or soil mapping, is the process of classifying soil types and other soil properties in a given area and geo-encoding such information. Background Soil surveys apply the principles of soil science and draw heavily from geomorphology, theories of soil formation, physical geography, and analysis of vegetation and land use patterns. Primary data for the soil survey are acquired by field sampling and by remote sensing. Remote sensing principally uses aerial...

Bengali-speaking tribal community For the Assamese surname, see Baruah. This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Barua Bangladesh – news · newspapers · books · scholar · JSTOR (January 2021) (Learn how and when to remove this template message) BaruaTotal population1.2 million[citation needed&...

Bulbophyllum odoratum Klasifikasi ilmiah Kerajaan: Plantae (tanpa takson): Angiospermae (tanpa takson): Monocots Ordo: Asparagales Famili: Orchidaceae Genus: Bulbophyllum Spesies: Bulbophyllum odoratum Nama binomial Bulbophyllum odoratum(Blume) Lindl. 1830 Bulbophyllum odoratum adalah spesies tumbuhan yang tergolong ke dalam famili Orchidaceae. Spesies ini juga merupakan bagian dari ordo Asparagales.[1] Spesies Bulbophyllum odoratum sendiri merupakan bagian dari genus Bulbophyllum.[1]...

Voce principale: Associazione Calcio Prato. Prato Sport ClubStagione 1922-1923Sport calcio Squadra Prato Allenatore György Kőszegy Seconda Divisione3º (Girone F) 1921-1922 1923-1924 Si invita a seguire il modello di voce Questa voce raccoglie le informazioni riguardanti il Prato Sport Club nelle competizioni ufficiali della stagione 1922-1923. Rosa N. Ruolo Calciatore C Antonio Bacci D Biancalana C Brogi (II) A Ettore Chenet D Mazzino Chiti D Nello Corti D Galli N. Ruolo Calciatore P...

Cet article décrit en détail l'effondrement des dictatures communistes, dites « démocraties populaires » dans sept pays d'Europe centrale et de l'Est : Albanie, Allemagne de l'Est (RDA), Bulgarie, Hongrie, Pologne, Tchécoslovaquie et Roumanie. Les dernières années de l'Union soviétique jusqu'à sa disparition fin 1991 sont évoquées dans cet article en tant qu'élément de contexte fondamental à la compréhension des évènements dans ses États satellites, mais son...

Виноград для ледяного вина, замороженный на лозе Ледяное вино (также айсвайн[1]; нем. Eiswein) — дорогое коллекционное десертное вино с густым букетом, изготовляемое из винограда, замороженного на лозе. Изначально было специалитетом Германии и Австрии (как одно из п�...

Rapid transit station in Philadelphia 11th Street11th Street stationGeneral informationOther names11th Street–Pennsylvania Convention CenterLocation11th and Market StreetsPhiladelphia, PennsylvaniaCoordinates39°57′07″N 75°09′24″W / 39.952076°N 75.156612°W / 39.952076; -75.156612Owned byCity of PhiladelphiaOperated bySoutheastern Pennsylvania Transportation AuthorityPlatforms2 side platformsTracks2Connections Regional Rail (at Jefferson) SEPTA City Bus: 17...

هذه المقالة عن المجموعة العرقية الأتراك وليس عن من يحملون جنسية الجمهورية التركية أتراكTürkler (بالتركية) التعداد الكليالتعداد 70~83 مليون نسمةمناطق الوجود المميزةالبلد القائمة ... تركياألمانياسورياالعراقبلغارياالولايات المتحدةفرنساالمملكة المتحدةهولنداالنمساأسترالي�...

Livre de DurrowDébut de l'évangile de Marc, f.86rDate fin du VIIe siècleTechnique enluminures sur parcheminDimensions (H × L) 24,5 × 14,5 cmFormat 248 folios reliésNo d’inventaire Ms.57Localisation Bibliothèque de Trinity College, Dublin ( Irlande)modifier - modifier le code - modifier Wikidata Le Livre de Durrow (Book of Durrow en anglais) est un évangéliaire manuscrit enluminé de la fin du VIIe siècle typique de l'art hiberno-saxon. Il a l...

Educational views of Brazilian Integralism A group of children at Minas Gerais (1940), dressed in Brazilian Integralist uniform and saluting. Integral Education (Portuguese: Educação Integral) is a concept within Brazilian Integralism, referring to an educational model that would address students from an Integralist point of view, aimed at educating holistically both physical, intellectual, civic and spiritual aspects of human beings.[1] Integral Education was deeply influenced by c...

Maxim VengerovМаксим Александрович ВенгеровInformasi latar belakangNama lahirMaxim Alexandrovich VengerovLahir20 Agustus 1974 (umur 49)Novosibirsk, RSFS Rusia, Uni Soviet[1][2]Genre Klasik Musik kamar Pekerjaan Musisi Konduktor Profesor InstrumenBiola, ViolaTahun aktif1984–saat iniLabel Teldec EMI Classics VMV (Vengerov Music Vision) Artis terkaitZakhar BronSitus webwww.nfbm.com/maxim-vengerov/ Maxim Alexandrovich Vengerov[a] (bahasa R...

This article is about the present-day Austrian state. For the historical state, see Duchy of Carinthia. For the Slovene region, see Carinthia (Slovenia). For other uses, see Carinthia (disambiguation). Not to be confused with Corinthia. State of Austria State in AustriaCarinthia Kärnten (German) Koroška (Slovene)State FlagCoat of armsAnthem: Kärntner Heimatlied [de] Country AustriaCapitalKlagenfurtGovernment • BodyLandtag of Carinthia • G...

AGATA Tipoassociazione di categoria Affiliazione internazionaleIFPI Fondazione1999 Sede centrale Vilnius PresidenteAgnė Begetė Sito web Modifica dati su Wikidata · Manuale AGATA è un'organizzazione non governativa non a scopo di lucro nata nel 1999. Dal 2011 rappresenta l'industria musicale della Lituania e i musicisti, interpreti, autori e compositori che ne fanno parte. AGATA è un membro associato dell'International Federation of the Phonographic Industry (IFPI). Dal 28 settembre ...

Bassa BergamascaBàsa Bergamasca (in dialetto bergamasco) Paesaggio agricolo della campagna trevigliese Stati Italia Regioni Lombardia (provincia di Bergamo) Territorioparte meridionale della provincia di Bergamo CapoluogoTreviglio Superficie600 km² Abitanti263 923 (2020) Densità439,87 ab./km² Lingueitaliano, bergamasco Fusi orariUTC+1 I comuni della bassa bergamasca divisa dal Serio e dal Fosso Bergamasco L'ex circondario di Treviglio della provincia di B...

Jangan MarahAlbum studio karya Trio Kwek KwekDirilis16 Agustus 1995GenrePopLabelIdeal RecordMusica Studio'sKronologi Trio Kwek Kwek Semua Oke(1994)Semua Oke1994 Jangan Marah (1995) Tanteku(1996)Tanteku1996 Jangan Marah adalah album musik ketiga karya Trio Kwek Kwek yang dirilis pada tahun 1995. Berisi 10 buah lagu dengan lagu berjudul sama dengan album, Jangan Marah sebagai lagu utama album ini.[1] Daftar lagu Judul lagu Pencipta Jangan Marah Papa T Bob Sapi Sapiku Om Faizal Ke Pe...

Historical evolution of the Holy Roman Empire overlaid on modern borders This list of states in the Holy Roman Empire includes any territory ruled by an authority that had been granted imperial immediacy, as well as many other feudal entities such as lordships, sous-fiefs, and allodial fiefs. The Holy Roman Empire was a complex political entity that existed in central Europe for most of the medieval and early modern periods and was generally ruled by a German-speaking Emperor. The states tha...

Papa Clemente IXClemente IX, ritratto da Carlo Maratta (1669)238º papa della Chiesa cattolica Elezione20 giugno 1667 Incoronazione26 giugno 1667 Fine pontificato9 dicembre 1669(2 anni e 172 giorni) MottoAliis non sibi clemens Cardinali creativedi Concistori di papa Clemente IX Predecessorepapa Alessandro VII Successorepapa Clemente X NomeGiulio Rospigliosi NascitaPistoia, 27 gennaio 1600 Ordinazione sacerdotalein data sconosciuta Nomina ad arcivescovo14 marzo 1644 da papa Urb...

Community college in San Antonio, Texas, U.S. For other schools with the name St. Philip's College, see St. Philip's College (disambiguation). This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: St. Philip's College United States – news · newspapers · books · scholar · JSTOR (April 2017) (Learn how and when...