Elektrosyntûˋza je oznaáenûÙ pro metody syntûˋzy chemickû§ch slouáenin pomocûÙ elektrochemickû§ch álûÀnké₤.[1][2][3][4]
Ve srovnûÀnûÙ s báéƒnû§mi redoxnûÙmi reakcemi se v elektrosyntûˋzûÀch mé₤éƒe nákdy dosahovat vyéÀéÀûÙch selektivit a vû§táéƒké₤. Elektrosyntûˋzy jsou áasto zkoumûÀny a majûÙ i pré₤myslovûÀ vyuéƒitûÙ. Elektrooxidace mohou bû§t napéûÙklad pouéƒity péi zpracovûÀnûÙ odpadnûÙch vod.
ProvedenûÙ
ZûÀkladnûÙmi zaéûÙzenûÙmi pouéƒûÙvanû§mi péi elektrosyntûˋzûÀch jsou galvanickû§ álûÀnek, potenciostat a dvojice elektrod. RozpouéÀtádlo a elektrolyt se vybûÙrajûÙ tak, aby elektrickû§ odpor byl co nejmenéÀûÙ.[5]
K zûÙskûÀnûÙ protickûˋho prostéedûÙ áasto slouéƒûÙ smási vody s alkoholy nebo dioxanem; jako elektrolyty se pouéƒûÙvajûÙ rozpustnûˋ soli, kyseliny nebo zûÀsady. Aprotickûˋ podmûÙnky se obvykle navozujûÙ organickû§mi rozpouéÀtádly, napéûÙklad acetonitrilem nebo dichlormethanem, a elektrolyty jako jsou chloristan lithnû§ ái tetrabutylamonnûˋ soli. Velkû§ vliv mé₤éƒe mûÙt sloéƒenûÙ a plocha povrchu elektrod,[6] ve vodnûˋm prostéedûÙ se jako produkty vedlejéÀûÙch reakcûÙ vytvûÀéûÙ na anodá kyslûÙk a na katodá vodûÙk. K zabrûÀnánûÙ támto reakcûÙm lze pouéƒûÙt grafitovou anodu s olovánou katodou. PouéƒûÙvajûÙ se i jinûˋ materiûÀly pro elektrody, napéûÙklad platina, hoéáûÙk, rtuéË nebo nerezovûÀ ocel. Péi nákterû§ch reakcûÙch se elektrody spotéebovûÀvajûÙ, v takovûˋm péûÙpadá mé₤éƒe bû§t materiûÀlem napéûÙklad zinek nebo olovo. álûÀnky mohou bû§t nerozdálenûˋ nebo rozdálenûˋ. U rozdálenû§ch jsou katoda a anoda oddáleny polopropustnou membrûÀnou, vyrobenou napéûÙklad ze spûˋkanûˋho skla, porûˋznûÙho porcelûÀnu, polytetrafluorethylenu nebo polypropylenu. Rozdálenûˋ álûÀnky umoéƒéujûÙ difû¤zi ionté₤ a souáasná omezujûÙ tok produkté₤ a reaktanté₤. Jako péûÙklad reakce s vyuéƒitûÙm rozdálenû§ch álûÀnké₤ lze uvûˋst redukci nitrobenzenu na fenylhydroxylamin, kde by druhûÀ z uvedenû§ch lûÀtek mohla oxidovat anodu.
Reakce
Na anodûÀch probûÙhajûÙ oxidace, na katodûÀch redukce. ûvodnûÙ reakce probáhne na povrchu elektrody a nûÀsledná meziprodukty difundujûÙ roztokem a û¤áastnûÙ se sekundûÀrnûÙch reakcûÙ. Meziprodukty áasto bû§vajûÙ radikûÀly.
ûáinnosti elektrosyntetickû§ch reakcûÙ lze vyjûÀdéit pomocûÙ vû§táéƒnosti i û¤áinnosti proudu. ûáinnost proudu se uráuje jako pomár elektrickûˋho nûÀboje spotéebovanûˋho na vznik produkté₤ a nûÀboje, kterû§ proéÀel álûÀnkem. VedlejéÀûÙ reakce û¤áinnost proudu sniéƒujûÙ.
Rychlost reakce je uráovûÀna rozdûÙlem potenciûÀlé₤ mezi elektrodami. Elektrosyntûˋzy probûÙhajûÙ za stûÀlûˋho potenciûÀlu nebo stûÀlûˋho proudu; vû§bár jednûˋ z táchto moéƒnostûÙ zûÀvisûÙ na vyvûÀéƒenûÙ snadnosti provedenûÙ a û¤áinnosti proudu. StûÀlû§ potenciûÀl je û¤áinnájéÀûÙ neéƒ stûÀlû§ proud a álûÀnek se v pré₤báhu reakce zmenéÀuje vlivem spotéebovûÀvûÀnûÙ substrûÀtu okolo elektrody (ke zmenéÀenûÙ difû¤znûÙ vrstvy kolem elektrody je zpravidla potéeba reakánûÙ smás promûÙchûÀvat). Za stûÀlûˋho proudu dochûÀzûÙ se sniéƒovûÀnûÙm koncentrace substrûÀtu ke snûÙéƒenûÙ potenciûÀlu na álûÀnku, áûÙméƒ se udréƒuje stûÀlûÀ rychlost reakce; áûÀst proudu se péitom spotéebovûÀvûÀ na vedlejéÀûÙ reakce.
Oxidace na anodûÀch
![]()
- Obmánami jsou nekolbeovskûˋ reakce, kdy je navûÀzûÀn heteroatom (dusûÙk nebo kyslûÙk) do polohy öÝ. Oxoniovû§ meziprodukt je zachycen nukleofilem, jûÙméƒ vátéÀinou bû§vûÀ rozpouéÀtádlo.

- Anodovû§mi elektrosyntûˋzami lze oxidovat primûÀrnûÙ alifatickûˋ aminy na nitrily.[7]
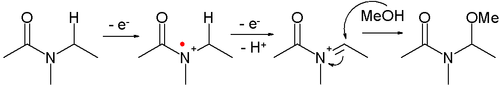
Tento druh reakce se oznaáuje jako Shonova oxidace. Jako péûÙklad mé₤éƒe slouéƒit öÝ-methoxylace N-karbomethoxypyrrolidinu.[8]

Redukce na katodûÀch
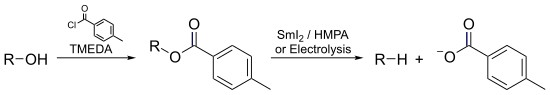
- 2 CH2=CHCN + 2 eã + 2 H+ ã NCCH2CH2CH2CH2CN
pré₤myslovûÀ vû§roba spoáûÙvûÀ v hydrodimerizaci aktivovanûˋho alkenu zûÙskanûˋho z akrylonitrilu:

a 2-methoxynaftalenu:



- Katodovou redukcûÙ nitroalkené₤ se, s dobrou vû§táéƒnostûÙ, vytvûÀéûÙ oximy. Péi vátéÀûÙch zûÀpornû§ch redukánûÙch potenciûÀlech lze nitroalkeny dûÀle redukovat na primûÀrnûÙ aminy, vû§táéƒnosti jsou ovéÀem niéƒéÀûÙ.[17]


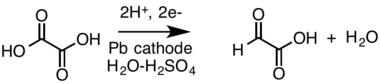
- HCO -
3 + H2O + 2 eã ã HCO -
2 + 2 OHã
nebo
- CO2 + H2O + 2 eã ã HCO -
2 + OHã
Kdyéƒ je surovinou oxid uhliáitû§ a na anodá se vyvûÙjûÙ kyslûÙk, celkovûÀ rovnice reakce je:
- 2 CO2 + 2 OHã ã 2 HCO -
2 + O2
RedoxnûÙ reakce
Elektrofluorace
éada perfluorovanû§ch slouáenin se vyrûÀbûÙ elektrochemicky, v kapalnûˋm fluorovodûÙku péi napátûÙ 5ã6 V pomocûÙ niklovû§ch anod. Tento postup byl vyvinut ve 30. letech 20. stoletûÙ.[25]
TûÙmto zpé₤sobem lze na perfluorovanûˋ produkty péemánit aminy, alkoholy, karboxylovûˋ a sulfonovûˋ kyseliny. Roztok nebo suspenze uhlovodûÙku ve fluorovodûÙku se elektrolyzuje péi 5 aéƒ 6 V, kdy se dosahuje nejlepéÀûÙch vû§táéƒnostûÙ.
Odkazy
SouvisejûÙcûÙ álûÀnky
Reference
V tomto álûÀnku byl pouéƒit péeklad textu z álûÀnku Electrosynthesis na anglickûˋ Wikipedii.
- ã Jeffrey B. Sperry; Dennis L. Wright. The application of cathodic reductions and anodic oxidations in the synthesis of complex molecules. Chemical Society Reviews. 2006, s. 605ã621. DOI 10.1039/b512308a. PMID 16791332.
- ã Topics in current chemistry. Electrochemistry, Vol. 3 (Topics in Current Chemistry, Vol. 148) E. Steckhan (Ed), Springer, NY 1988
- ã M. Yan; Y. Kawamata; P. S. Baran. Synthetic Organic Electrochemistry: Calling All Engineers. Angewandte Chemie International Edition. 2017, s. 4149ã4155. DOI 10.1002/anie.201707584. PMID 28834012.
- ã James Utley. Trends in Organic Electrosynthesis. Chemical Society Reviews. 1997, s. 157. DOI 10.1039/cs9972600157.
- ã a b James Grimshaw. Electrochemical Reactions and Mechanisms in Organic Chemistry. Amsterdam: Elsevier Science, 2000. Dostupnûˋ online. ISBN 9780444720078. S. 1ã7, 282, 310.
- ã D. M. Heard; A. J. J. Lennox. Electrode Materials in Modern Organic Electrochemistry. Angewandte Chemie International Edition. 2020-07-06, s. 18866ã18884. DOI 10.1002/anie.202005745. PMID 32633073.
- ã H. J. SchûÊfer; U. Feldhues. Oxidation of Primary Aliphatic Amines to Nitriles at the Nickel Hydroxide Electrode. Synthesis. 1982, s. 145ã146. DOI 10.1055/s-1982-29721.
- ã Organic Syntheses, Coll. Vol. 7, p.307 (1990); Vol. 63, p.206 (1985) [online]. Dostupnûˋ v archivu poéûÙzenûˋm z originûÀlu dne 2007-09-26. Je zde pouéƒita éÀablona
{{Cite web}} oznaáenûÀ jako k ãpouze doáasnûˋmu pouéƒitûÙã.
- ã Organic Syntheses, Coll. Vol. 7, p.482 (1990); Vol. 60, p.78 (1981) [online]. Dostupnûˋ v archivu poéûÙzenûˋm z originûÀlu dne 2007-09-26. Je zde pouéƒita éÀablona
{{Cite web}} oznaáenûÀ jako k ãpouze doáasnûˋmu pouéƒitûÙã.
- ã N. Hampson; J. Lee; K. MacDonald. The oxidation of amino compounds at anodic silver. Electrochimica Acta. 1972, s. 921ã955. DOI 10.1016/0013-4686(72)90014-X.
- ã a b Fructuoso Barba; Belen Batanero. Paired Electrosynthesis of Cyanoacetic Acid. The Journal of Organic Chemistry. 2004, s. 2423ã2426. DOI 10.1021/jo0358473. PMID 15049640.
- ã Wilhelm Riemenschneider. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2002. ISBN 3527306730. DOI 10.1002/14356007.a05_235. Kapitola Carboxylic Acids, Aliphatic.
- ã a b D. S. Cardoso; B. é ljukiá; D. M. Santos; S. A. Sequeira. Organic Electrosynthesis: From Laboratorial Practice to Industrial Applications. Organic Process Research & Development. 2017-07-17, s. 1213ã1226. DOI 10.1021/acs.oprd.7b00004.
- ã Electrochemistry Encyclopedia ã Tafel: his life and science [online]. Dostupnûˋ v archivu poéûÙzenûˋm z originûÀlu dne 2012-02-06.
- ã Julius Tafel; Hans Hahl. VollstûÊndige Reduktion des Benzylacetessigesters. Berichte der deutschen chemischen Gesellschaft. 1907, s. 3312ã3318. Dostupnûˋ online. DOI 10.1002/cber.190704003102.
- ã V. Krishnan; A. Muthukumaran; H. V. K. Udupa. The electroreduction of benzyl cyanide on iron and cobalt cathodes. Journal of Applied Electrochemistry. 1979, s. 657ã659. DOI 10.1007/BF00610957.
- ã M. Wessling; H. J. SchûÊfer. Cathodic reduction of 1-nitroalkenes to oximes and primary amines. Chemische Berischte. 1991, s. 2303ã2306. DOI 10.1002/cber.19911241024.
- ã Toshiyasu Sakakura; Jun-Chul Choi; Hiroyuki Yasuda. Transformation of Carbon dioxide. Chemical Reviews. 2007-06-13, s. 2365ã2387. DOI 10.1021/cr068357u. PMID 17564481.
- ã Julius Tafel; Gustav Friedrichs. Elektrolytische Reduction von CarbonsûÊuren und CarbonsûÊureestern in schwefelsaurer LûÑsung. Berichte der Deutschen Chemischen Gesellschaft. 1904, s. 3187ã3191. Dostupnûˋ online. DOI 10.1002/cber.190403703116.
- ã Julius Cohen. Practical Organic Chemistry. London: Macmillan and Co., 1920. Dostupnûˋ online. S. 102ã104.
- ã A. W. INGERSOLL. Hydrocinnamic acid. Org. Synth.. 1929, s. 42. Dostupnûˋ online. Je zde pouéƒita éÀablona
{{Citation}} oznaáenûÀ jako k ãpouze doáasnûˋmu pouéƒitûÙã.; Coll. Vol.. S. 311. Je zde pouéƒita éÀablona {{Citation}} oznaáenûÀ jako k ãpouze doáasnûˋmu pouéƒitûÙã.Je zde pouéƒita éÀablona {{OrgSynth}} oznaáenûÀ jako k ãpouze doáasnûˋmu pouéƒitûÙã.
- ã Elisabeth Bouwman; Raja Angamuthu; Philip Byers; Martin Lutz; Anthony L. Spek. Electrocatalytic CO2 Conversion to Oxalate by a Copper Complex. Science. 2010-07-15, s. 313ã315. Dostupnûˋ online. DOI 10.1126/science.1177981. PMID 20075248. Bibcode 2010Sci...327..313A.
- ã B. Innocent. Electro-reduction of carbon dioxide to formate on lead electrode in aqueous medium. Journal of Applied Electrochemistry. 2009, s. 227ã232. DOI 10.1126/science.1177981. PMID 10.1007/s10800-008-9658-4.
- ã Byungik Lee; Hiroto Naito; Masahiro Nagao; Takashi Hibino. Alternating-Current Electrolysis for the Production of Phenol from Benzene. Angewandte Chemie International Edition. 2012-07-09, s. 6961ã6965. DOI 10.1002/anie.201202159. PMID 22684819.
- ã J. H. Simons. Production of Fluorocarbons I. The Generalized Procedure and its Use with Nitrogen Compounds. Journal of the Electrochemical Society. 1949, s. 47ã52. DOI 10.1149/1.2776733.