| Ethyl-acetacetát |
|---|
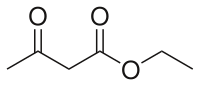 Strukturní vzorec |
 Model molekuly |
| Obecné |
|---|
| Systematický název | ethyl-3-oxobutanoát |
|---|
| Ostatní názvy | ethylacetacetát, ethylester kyseliny acetyloctové |
|---|
| Sumární vzorec | C6H10O3 |
|---|
| Vzhled | bezbarvá kapalina[1] |
|---|
| Identifikace |
|---|
| Registrační číslo CAS | 141-97-9 |
|---|
| EC-no (EINECS/ELINCS/NLP) | 205-516-1 |
|---|
| PubChem | 8868 |
|---|
| ChEBI | 17602 |
|---|
| SMILES | CCOC(=O)CC(=O)C |
|---|
| InChI | InChI=1S/C6H10O3/c1-3-9-6(8)4-5(2)7/h3-4H2,1-2H3 |
|---|
| Vlastnosti |
|---|
| Molární hmotnost | 130,14 g/mol |
|---|
| Teplota tání | −45 °C (228 K)[1] |
|---|
| Teplota varu | 180,8 °C (454,0 K)[1] |
|---|
| Rozpustnost ve vodě | 11 g/100 ml (17 °C)[1] |
|---|
Rozpustnost v polárních
rozpouštědlech | rozpustný v ethanolu, acetonu, ethylacetátu a chloroformu[1] |
|---|
Rozpustnost v nepolárních
rozpouštědlech | rozpustný v benzenu a diethyletheru[1] |
|---|
| Tlak páry | 0,1 kPa (20 °C)[1] |
|---|
| Bezpečnost |
|---|
 GHS05 GHS05 GHS07 GHS07
Nebezpečí[1] |
| H-věty | H315 H318 H319 H335[1] |
|---|
| P-věty | P261 P264 P271 P280 P302+352 P304+340 P305+351+338 P310 P312 P321 P332+313 P337+313 P362 P403+233 P405 P501[1] |
|---|
| Teplota vzplanutí | 84 °C (357 K)[1] |
|---|
| Teplota vznícení | 295 °C (568 K)[1] |
|---|
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa).
|
Ethyl-acetacetát (zkráceně EAA) je organická sloučenina, ethylester kyseliny acetyloctové. Slouží jako meziprodukt při výrobě řady dalších sloučenin a v potravinářství jako ochucovadlo.
Výroba
Ethyl-acetacetát se průmyslově vyrábí reakcí diketenu s ethanolem.[2]
V laboratoři se dá připravit Claisenovou kondenzací z ethyl-acetátu. Dva moly ethyl-acetátu kondenzují za vzniku jednoho molu ethyl-acetacetátu a jednoho molu ethanolu.

Reaktivita a použití
Kyselost
Ethyl-acetacetát funguje jako dvojsytná kyselina:[3]
- CH3C(O)CH2CO2Et + NaH → CH3C(O)CH(Na)CO2Et + H2
- CH3C(O)CH(Na)CO2Et + BuLi → LiCH2C(O)CH(Na)CO2Et + BuH
Keto-enol tautomerie
U ethyl-acetacetátu se vyskytuje tautomerie. V kapalném skupenství při 33 °C je podíl enolové formy 15 %.[4]
V organické syntéze
Ethylacetát se používá jako reaktant v organické syntéze, kde se využívá kyselosti protonu v poloze alfa vůči karbonylové skupině a toho, že u vzniklého karboaniontu dochází k nukleofilní substituci. Často se používá na přípravu esterů kyseliny acetyloctové podobným způsobem, jakým se z diethyl-malonátu získávají estery kyseliny malonové, a také v Knoevenagelových kondenzacích. Poté je možné provést tepelnou dekarboxylaci.[5]
Dianion ethylacetacetátu lze také použít jako reaktant, pokud se elektrofil nenavazuje na koncový uhlík. Tento postup lze znázornit následujícím vzorcem:[3]
- LiCH2C(O)CH(Na)CO2Et + RX → RCH2C(O)CH(Na)CO2Et + LiX
Ligand
Podobně jako u acetylacetonu může i enolát ethylacetacetátu sloužit jako bidentátní ligand. Jako příklad lze uvést tvorbu fialových komplexů se železitými solemi:
![]()
Reduction
Redukcí ethylacetacetátu vzniká ethyl-3-hydroxybutyrát.
Transesterifikace
Ethylacetacetát lze použít k transesterifikační přípravě benzylacetacetátu; meziproduktem je přitom acetylketen. Nitrosáty ethyl-acetacetátu lze za přítomnosti ekvimolárního množství dusitanu sodného v kyselině octové použít k nitrosacím, jejichž produkty jsou oximinoacetacetátové estery. Jejich redukce rozpouštěným zinkem v kyselině octové za přítomnosti ketoesterů nebo betadiketonů je podstatou Knorrovy syntézy pyrrolů, využívané při syntéze porfyrinů.
Odkazy
Související články
- Frukton, ketal ethylacetacetátu a ethylenglykolu, používaný jako aroma
Externí odkazy
Reference
V tomto článku byl použit překlad textu z článku Ethyl acetoacetate na anglické Wikipedii.