Amilorida
Amilorida adalah obat yang biasanya digunakan bersama obat lain untuk mengobati tekanan darah tinggi atau pembengkakan karena gagal jantung atau sirosis hati.[1][2] Amilorida diklasifikasikan sebagai diuretik hemat kalium. Amilorida sering digunakan bersama dengan diuretik lain, seperti tiazida atau diuretik kuat.[1] Obat ini diminum. Onset aksinya sekitar dua jam dan berlangsung sekitar satu hari.[2] Efek samping yang umum termasuk kalium darah tinggi, muntah, kehilangan nafsu makan, ruam, dan sakit kepala. Risiko kalium darah tinggi lebih besar pada mereka yang memiliki masalah ginjal, diabetes melitus, dan mereka yang lebih tua.[1] Amilorida memblokir saluran natrium epitel (ENaC) di tubulus distal akhir, tubulus penghubung, dan duktus pengumpul nefron,[3] yang keduanya mengurangi penyerapan ion natrium dari lumen nefron dan mengurangi ekskresi ion kalium ke dalam lumen.[2] Amilorida dikembangkan pada tahun 1967.[4] Obat ini ada dalam Daftar Obat Esensial Organisasi Kesehatan Dunia.[5] SejarahAmilorida pertama kali disintesis dan ditemukan oleh Laboratorium Riset Merck Sharp dan Dohme pada akhir tahun 1960-an. Obat ini ditemukan sebagai bagian dari proses penyaringan bahan kimia yang membalikkan efek mineralokortikoid secara in vivo. Amilorida adalah satu-satunya obat dalam penyaringan yang mampu menyebabkan ekskresi natrium (natriuresis) tanpa ekskresi kalium urin secara bersamaan (kaliuresis). Ribuan analog amilorida telah dipelajari sejak penemuan awalnya, yang telah digunakan untuk mempelajari efek transporter natrium.[6] Amilorida disetujui oleh Badan Pengawas Obat dan Makanan Amerika Serikat (FDA) pada tanggal 5 Oktober 1981.[7] Kegunaan medisAmilorida dapat digunakan dalam kombinasi dengan diuretik tiazida untuk pengobatan tekanan darah tinggi atau (lebih jarang) dalam kombinasi dengan diuretik loop untuk pengobatan gagal jantung. Efek hemat kalium dari amilorida mengimbangi kalium darah rendah (hipokalemia) yang sering disebabkan oleh tiazida atau diuretik loop, yang sangat penting bagi orang-orang yang harus untuk menjaga kadar kalium normal. Misalnya, orang yang mengonsumsi Digitalis (yaitu digoksin) berisiko lebih tinggi mengalami perubahan irama jantung jika kadar kaliumnya terlalu tinggi.[8] Pedoman praktik klinis 2017 dari American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines mencantumkan amilorida sebagai antihipertensi oral "sekunder", dengan efikasi minimal.[9] Bagi penderita hipertensi resistan yang sudah mengonsumsi diuretik tiazida, penghambat enzim pengubah angiotensin (ACE inhibitor) atau Antagonis reseptor angiotensin II (ARB), dan penghalang saluran kalsium; penambahan amilorida (atau spironolakton) lebih baik dalam menurunkan tekanan darah dibandingkan dengan penambahan penyekat beta (seperti bisoprolol) atau penyekat alfa-1 (seperti doksazosin).[10] Ketika dikombinasikan dengan hidroklorotiazida, penambahan amilorida memiliki efek positif pada tekanan darah dan toleransi gula darah.[11] Oleh karena itu, amilorida mungkin berguna untuk mencegah efek samping metabolik diuretik tiazida, sehingga memungkinkan penggunaan dosis tiazida yang lebih tinggi (sesuai dengan cara awalnya dipelajari).[12] Amilorida adalah pengobatan pilihan untuk fenotipe Liddle,[13] yang ditandai dengan tekanan darah tinggi, kalium darah rendah, dan alkalosis metabolik bersamaan dengan aktivitas renin plasma rendah dan aldosteron rendah. Beberapa orang dengan fenotipe Liddle memiliki sindrom Liddle, yang melibatkan mutasi genetik yang mengakibatkan peningkatan regulasi saluran natrium epitel (ENaC), yang terletak di membran apikal sel epitel terpolarisasi di tubulus distal akhir dan duktus pengumpul ginjal.[14] Karena fenotipe Liddle biasanya melibatkan peningkatan regulasi saluran ENaC, yang menyebabkan retensi natrium dan air serta hipokalemia, amilorida berguna sebagai penghambat saluran ENaC karena peningkatan ekskresi natrium dan efek penghemat kaliumnya, memulihkan kalium ke kadar normal.[15] Amilorida dapat digunakan sebagai monoterapi (terapi obat tunggal) atau terapi tambahan bersama diuretik lain (misalnya hidroklorotiazida atau furosemid) untuk pengobatan asites dan edema (sembap) akibat sirosis hati.[8] Pedoman praktik klinis tahun 2012 oleh American Association for the Study of Liver Diseases (AASLD) menyatakan bahwa amilorida dapat digunakan untuk mengobati asites sebagai pengganti spironolakton jika tidak ditoleransi (misalnya karena efek samping ginekomastia), meskipun amilorida bukanlah obat pilihan karena biaya dan kurangnya kemanjuran.[16] Populasi tertentuPenderita diabetesOrang dengan diabetes melitus berisiko lebih tinggi mengalami masalah ginjal, yang meningkatkan risiko hiperkalemia (kalium darah tinggi). Penggunaan amilorida pada penderita diabetes memerlukan pemantauan kalium dan fungsi ginjal yang cermat untuk mencegah toksisitas. Amilorida harus dihentikan setidaknya 3 hari sebelum pengujian toleransi glukosa, karena risiko hiperkalemia yang fatal.[8] Fungsi ginjal yang burukOrang dengan fungsi ginjal yang buruk (misalnya nitrogen urea darah >30 mg/dL, atau kreatinina serum >1,5 mg/dL) berisiko tinggi mengalami hiperkalemia.[8] LaktasiTidak ada data tentang penggunaan amilorida pada wanita yang sedang menyusui. Meskipun diuretik dapat mempersulit laktasi, kecil kemungkinan amilorida akan menyebabkan efek ini jika tidak ada diuretik lain.[17] KehamilanData dari penggunaan amilorida pada hewan menunjukkan bahwa amilorida tidak menimbulkan risiko bagi perkembangan janin. Namun, bila digunakan dalam kombinasi dengan obat asetazolamida selama proses pembentukan organ, amilorida meningkatkan risiko kelainan ginjal dan ureter. Data terbatas pada manusia dari penggunaan selama kehamilan menunjukkan adanya hubungan dengan kelainan kongenital penis tertentu jika dikonsumsi selama trimester pertama, serta risiko hambatan pertumbuhan intrauterin ringan jika dikonsumsi selama kehamilan.[18] KontraindikasiAmilorida dikontraindikasikan pada orang dengan masalah ginjal (misalnya anuria, gagal ginjal akut atau kronis, atau nefropati diabetik), kalium darah tinggi (≥5,5 mEq/L), atau orang yang hipersensitif terhadap amilorida atau bahan apa pun dalam formulasi spesifik. Penggunaan juga dikontraindikasikan pada orang yang sudah mengonsumsi diuretik hemat kalium (misalnya spironolakton dan triamteren) atau yang mengonsumsi suplemen kalium (misalnya kalium klorida) dalam sebagian besar keadaan.[1] Efek sampingAmilorida umumnya ditoleransi dengan baik.[19] Efek samping umum dari penggunaan amilorida meliputi peningkatan kalium darah, ruam kulit ringan, sakit kepala, dan efek samping gastrointestinal (mual, muntah, diare, nafsu makan menurun, flatulensi, dan sakit perut). Gejala ringan dari konsentrasi kalium darah tinggi meliputi sensasi kulit yang tidak biasa, kelemahan otot, atau kelelahan, tetapi gejala yang lebih parah seperti kelumpuhan lembek pada anggota badan, denyut jantung lambat, dan bahkan syok dapat terjadi.[1] OverdosisTidak ada data overdosis pada amilorida pada manusia, meskipun diperkirakan overdosis akan menghasilkan efek yang konsisten dengan efek terapeutiknya; misalnya dehidrasi karena diuresis berlebihan, dan gangguan elektrolit terkait hiperkalemia. Tidak diketahui apakah amilorida dapat dihilangkan dengan dialisis, dan tidak ada penawar khusus untuk itu. Pengobatan umumnya bersifat suportif, meskipun hiperkalemia dapat diobati.[19] InteraksiAmilorida dapat memiliki interaksi obat-obat yang penting jika dikombinasikan dengan obat lain yang juga meningkatkan kadar kalium dalam darah, yang menyebabkan hiperkalemia. Misalnya, kombinasi amilorida dengan penghambat enzim pengubah angiotensin (ACE inhibitor) seperti lisinopril, atau antagonis reseptor angiotensin II tipe 1 (AT1) seperti losartan, dapat menyebabkan kadar kalium tinggi dalam darah, sehingga memerlukan pemantauan yang sering.[20] FarmakologiMekanisme kerjaDiuresisAmilorida bekerja dengan langsung memblokir saluran natrium epitel (ENaC) dengan IC50 sekitar 0,1 μM; yang menunjukkan blokade yang kuat.[21] Antagonisme ENaC dengan demikian menghambat reabsorpsi natrium di tubulus kontortus distal akhir, tubulus penghubung, dan duktus pengumpul di nefron.[22] Hal ini mendorong hilangnya natrium dan air dari tubuh, dan mengurangi ekskresi kalium. Obat ini sering digunakan bersama dengan diuretik tiazida untuk mengatasi efek kehilangan kalium. Karena kapasitasnya dalam menghemat kalium, hiperkalemia (peningkatan konsentrasi kalium dalam darah) dapat terjadi. Risiko terjadinya hiperkalemia meningkat pada pasien yang juga mengonsumsi ACE inhibitor, antagonis reseptor angiotensin II, diuretik hemat kalium lainnya, atau suplemen yang mengandung kalium. Lain-lainSebagian kecil efek amilorida adalah penghambatan saluran kation berpagar GMP siklik di duktus pengumpul medula bagian dalam.[23] Amilorida memiliki tindakan kedua pada jantung, yaitu memblokir penukar Na+/H+ seperti antiporter natrium-hidrogen 1 (NHE-1). Amilorida juga memblokir antiporter Na+/H+ pada permukaan apikal sel tubulus proksimal di nefron, sehingga menghilangkan lebih dari 80% tindakan angiotensin II pada sekresi ion hidrogen di sel tubulus proksimal.[24] Amilorida bukan antagonis reseptor angiotensin II (seperti losartan misalnya). Transporter Na-H juga ditemukan di Jejunum usus halus, sebagai hasilnya, amilorida juga menghambat penyerapan kembali Na, dan dengan demikian air di usus.[25] Amilorida dianggap sebagai penghambat saluran ion penginderaan asam pan-asam (ASIC) reversibel yang mencegah aliran ion sementara tetapi bukan aliran ion berkelanjutan. ASIC adalah anggota keluarga saluran protein ENaC, dan ditemukan dalam sistem saraf, sistem kardiovaskular, sistem gastrointestinal, dan kulit. Secara umum, ASIC terlibat dalam deteksi bahaya, kemosensasi (perubahan pH khususnya), dan sentuhan.[26] FarmakokinetikAbsorpsiAmilorid memiliki bioavailabilitas oral sebesar 50%, yang berarti sekitar 50% dari dosis oral diabsorpsi ke dalam aliran darah. Pemberian bersamaan dengan makanan mengurangi jumlah amilorida yang diabsorpsi oleh tubuh sekitar 30%, meskipun tidak memengaruhi laju absorpsi. Namun, mengonsumsi amilorida bersama makanan membantu mengurangi kejadian efek samping gastrointestinalnya. Setelah dikonsumsi, efek diuretik amilorid terjadi dalam waktu 2 jam, dengan puncak diuresis dalam waktu 6–10 jam. Efek diuretik amilorid bertahan selama sekitar 24 jam setelah pemberian.[1] DistribusiAmilorid melewati plasenta dan terdistribusi ke dalam ASI secara in vivo.[1] MetabolismeAmilorida tidak dimetabolisme oleh hati.[1] Sebagai perbandingan, penghambat ENaC triamteren dimetabolisme oleh hati.[27] EkskresiSekitar 50% amilorida diekskresikan tanpa diubah oleh ginjal, sementara sekitar 40% diekskresikan dalam tinja (kemungkinan obat yang tidak diserap). Waktu paruh amilorida pada manusia adalah antara 6 dan 9 jam, yang dapat diperpanjang pada orang dengan fungsi ginjal yang buruk.[1] FarmakogenomikPolimorfisme nukleotida tunggal (SNP) dalam protein NEDD4L dapat memengaruhi bagaimana amilorida memengaruhi tekanan darah seseorang dalam kasus hipertensi (tekanan darah tinggi).[28] Kimia Amilorida adalah pirazinoilguanidin, yang terdiri dari struktur cincin pirazina tersubstitusi dengan substituen karbonilguanidinium. pKa amilorida adalah 8,67; yang disebabkan oleh gugus guanidinium. Dalam lingkungan pH tinggi (basa, konsentrasi hidrogen rendah), gugus guanidinium dideprotonasi dan senyawa tersebut menjadi netral, sehingga aktivitasnya pada saluran natrium berkurang.[6] Amilorida, sebagai zat murni, sangat berfluoresensi, dengan panjang gelombang eksitasi pada 215, 288, dan 360 nm, memancarkan cahaya pada 420 nm.[29]  Masyarakat dan budayaObat ini tercantum dalam Daftar Obat Esensial Organisasi Kesehatan Dunia.[5] Amilorida tercantum dalam daftar zat terlarang Badan Antidoping Dunia, karena dianggap sebagai zat penopeng.[30] Diuretik seperti amilorida bertindak sebagai agen penyamaran dengan mengurangi konsentrasi agen doping lain karena meningkatkan diuresis, sehingga meningkatkan volume total urin.[27] Daftar ini mencakup diuretik hemat kalium lainnya seperti triamteren dan spironolakton.[30] Pada tahun 2008, amilorida dan triamteren ditemukan dalam 3% sampel doping diuretik positif.[27] Formulasi dan nama dagang
PenelitianAmilorida adalah penghambat NHE-1, yang membantu menjaga pH normal di dalam sel. Sel kanker pada leukemia, salah satu jenis kanker darah, memiliki pH yang lebih tinggi dibandingkan dengan sel normal. Amilorida memengaruhi penyambungan dan regulasi beberapa gen yang terlibat dalam kanker, meskipun tampaknya tidak berhubungan langsung dengan efeknya pada pH. Amilorida telah diuji secara in vitro sebagai tambahan untuk obat antikanker imatinib, yang tampaknya menunjukkan efek sinergis. Versi amilorida yang dimodifikasi, yang dikenal sebagai 5'-(N,N-dimetil)-amilorida (DMA), 5-N-etil-N-isopropil amilorida (EIPA), dan 5-(N,N-heksametilen)-amilorida (HMA), sedang dipelajari untuk pengobatan leukemia.[31]
Referensi
Pranala luar
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
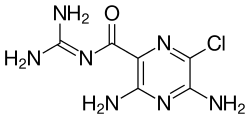

![Side-by-side comparison of the chemical structures of amiloride and one of its analogues, research name 552-02 (N-(3,5-diamino-6-chloropyrazine-2-carbonyl)-N'-4-[4-(2,3-dihydroxypropoxy)phenyl]butyl-guanidine methanesulfonate).](http://upload.wikimedia.org/wikipedia/commons/1/15/Amiloride55202.jpg)













