–†–Њ–Ј–њ–Њ–і—Ц–ї —Ц–Ј–Њ—В–Њ–њ—Ц–≤.–њ—А–Њ—В–Њ–љ—Ц–≤ (–Ј–∞—А—П–і —П–і—А–∞ ).–љ–µ–є—В—А–Њ–љ—Ц–≤ .–љ–∞–њ—Ц–≤—А–Њ–Ј–њ–∞–і—Г ). –Ж–Ј–Њ—В–ЊћБ–њ–Є вАФ –љ—Г–Ї–ї—Ц–і–Є –Њ–і–љ–Њ–≥–Њ —Ц —В–Њ–≥–Њ —Б–∞–Љ–Њ–≥–Њ —Е—Ц–Љ—Ц—З–љ–Њ–≥–Њ –µ–ї–µ–Љ–µ–љ—В—Г , —П–Ї—Ц –Љ–∞—О—В—М —А—Ц–Ј–љ—Г –Ї—Ц–ї—М–Ї—Ц—Б—В—М –љ–µ–є—В—А–Њ–љ—Ц–≤ , –∞, –Њ—В–ґ–µ, —А—Ц–Ј–љ–µ –Љ–∞—Б–Њ–≤–µ —З–Є—Б–ї–Њ —Ц —А—Ц–Ј–љ—Г –∞—В–Њ–Љ–љ—Г –Љ–∞—Б—Г .
–Ж–Ј–Њ—В–Њ–њ–Є –њ–Њ–Ј–љ–∞—З–∞—О—В—М —В–Є–Љ–Є —Б–∞–Љ–Є–Љ–Є —Б–Є–Љ–≤–Њ–ї–∞–Љ–Є, —Й–Њ –є —Е—Ц–Љ—Ц—З–љ–Є–є –µ–ї–µ–Љ–µ–љ—В , –і–Њ–і–∞—О—З–Є –Ј–≤–µ—А—Е—Г –Ј –ї—Ц–≤–Њ–≥–Њ –±–Њ–Ї—Г —Б–Є–Љ–≤–Њ–ї—Г –Љ–∞—Б–Њ–≤–µ —З–Є—Б–ї–Њ , –љ–∞–њ—А–Є–Ї–ї–∞–і, —Ц–Ј–Њ—В–Њ–њ–Є —Е–ї–Њ—А—Г –њ–Њ–Ј–љ–∞—З–∞—О—В—М: 35 Cl37 Cl
–Ж–Ј–Њ—В–Њ–њ–Є –Њ–і–љ–Њ–≥–Њ —Е—Ц–Љ—Ц—З–љ–Њ–≥–Њ –µ–ї–µ–Љ–µ–љ—В–∞ –Љ–∞—О—В—М –Њ–і–љ–∞–Ї–Њ–≤–Є–є –Ј–∞—А—П–і –∞—В–Њ–Љ–љ–Њ–≥–Њ —П–і—А–∞ , —В–Њ–±—В–Њ –Њ–і–Є–љ –њ–Њ—А—П–і–Ї–Њ–≤–Є–є –љ–Њ–Љ–µ—А, —Ц –Ј–∞–є–Љ–∞—О—В—М —В–µ –ґ —Б–∞–Љ–µ –Љ—Ц—Б—Ж–µ –≤ –њ–µ—А—Ц–Њ–і–Є—З–љ—Ц–є —Б–Є—Б—В–µ–Љ—Ц , –Љ–∞—О—В—М –Њ–і–љ–∞–Ї–Њ–≤—Г –Ї—Ц–ї—М–Ї—Ц—Б—В—М –њ—А–Њ—В–Њ–љ—Ц–≤ –≤ —П–і—А—Ц –∞—В–Њ–Љ–∞, –∞–ї–µ –≤—Ц–і—А—Ц–Ј–љ—П—О—В—М—Б—П –Њ–і–Є–љ –≤—Ц–і –Њ–і–љ–Њ–≥–Њ –Ї—Ц–ї—М–Ї—Ц—Б—В—О –љ–µ–є—В—А–Њ–љ—Ц–≤ . –Ґ–∞–Ї, –≤ –∞—В–Њ–Љ–љ–Њ–Љ—Г —П–і—А—Ц —Ц–Ј–Њ—В–Њ–њ—Г —Е–ї–Њ—А—Г 35 Cl –Љ—Ц—Б—В–Є—В—М—Б—П 17 –њ—А–Њ—В–Њ–љ—Ц–≤, –Њ—Б–Ї—Ц–ї—М–Ї–Є –њ–Њ—А—П–і–Ї–Њ–≤–Є–є –љ–Њ–Љ–µ—А —Е–ї–Њ—А—Г 17, —Ц 18 –љ–µ–є—В—А–Њ–љ—Ц–≤ (35-17=18), –∞ –≤ —П–і—А—Ц —Ц–Ј–Њ—В–Њ–њ—Г —Е–ї–Њ—А—Г 37 Cl вАФ 17 –њ—А–Њ—В–Њ–љ—Ц–≤ —Ц 20 –љ–µ–є—В—А–Њ–љ—Ц–≤ (37-17 = 20).
–Ф–µ—П–Ї—Ц —Е—Ц–Љ—Ц—З–љ—Ц –µ–ї–µ–Љ–µ–љ—В–Є –Љ–∞—О—В—М –љ–µ–≤–µ–ї–Є–Ї—Г –Ї—Ц–ї—М–Ї—Ц—Б—В—М —Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤. –Ґ–∞–Ї, –і–ї—П –Ї–Є—Б–љ—О –≤—Ц–і–Њ–Љ–Њ —В—А–Є —Б—В–∞–±—Ц–ї—М–љ—Ц —Ц–Ј–Њ—В–Њ–њ–Є: 16 O (—П–і—А–Њ —Б–Ї–ї–∞–і–∞—Ф—В—М—Б—П –Ј 8 –њ—А–Њ—В–Њ–љ—Ц–≤ —Ц 8 –љ–µ–є—В—А–Њ–љ—Ц–≤), 17 O (—П–і—А–Њ —Б–Ї–ї–∞–і–∞—Ф—В—М—Б—П –Ј 8 –њ—А–Њ—В–Њ–љ—Ц–≤ —Ц 9 –љ–µ–є—В—А–Њ–љ—Ц–≤) —Ц 18 –Ю (—П–і—А–Њ —Б–Ї–ї–∞–і–∞—Ф—В—М—Б—П –Ј 8 –њ—А–Њ—В–Њ–љ—Ц–≤ —Ц 10 –љ–µ–є—В—А–Њ–љ—Ц–≤). –Ф–ї—П –≤–Њ–і–љ—О –≤—Ц–і–Њ–Љ–Њ —В–µ–ґ —В—А–Є —Ц–Ј–Њ—В–Њ–њ–Є: 1 H (—П–і—А–Њ —Б–Ї–ї–∞–і–∞—Ф—В—М—Б—П –ї–Є—И–µ –Ј –Њ–і–љ–Њ–≥–Њ –њ—А–Њ—В–Њ–љ–∞), 2 H (—П–і—А–Њ —Б–Ї–ї–∞–і–∞—Ф—В—М—Б—П –Ј –Њ–і–љ–Њ–≥–Њ –њ—А–Њ—В–Њ–љ–∞ —Ц –Њ–і–љ–Њ–≥–Њ –љ–µ–є—В—А–Њ–љ–∞), 3 H (—П–і—А–Њ —Б–Ї–ї–∞–і–∞—Ф—В—М—Б—П –Ј –Њ–і–љ–Њ–≥–Њ –њ—А–Њ—В–Њ–љ–∞ —Ц –і–≤–Њ—Е –љ–µ–є—В—А–Њ–љ—Ц–≤). –Ф–µ—П–Ї—Ц –ґ —Е—Ц–Љ—Ц—З–љ—Ц –µ–ї–µ–Љ–µ–љ—В–Є —Б–Ї–ї–∞–і–∞—О—В—М—Б—П –Ј –і–Њ—Б–Є—В—М –≤–µ–ї–Є–Ї–Њ—Ч –Ї—Ц–ї—М–Ї–Њ—Б—В—Ц —Ц–Ј–Њ—В–Њ–њ—Ц–≤. –Э–∞–њ—А–Є–Ї–ї–∞–і, –Ї—Б–µ–љ–Њ–љ –Љ–∞—Ф 9 —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —Г –њ—А–Є—А–Њ–і–љ—Ц–є —Б—Г–Љ—Ц—И—Ц, –Њ–ї–Њ–≤–Њ вАФ 10 —Ц —В. –і.; –і–ї—П —Ж–Є—Е –µ–ї–µ–Љ–µ–љ—В—Ц–≤ —В–∞–Ї–Њ–ґ –≤—Ц–і–Њ–Љ—Ц –і–µ—Б—П—В–Ї–Є —И—В—Г—З–љ–Є—Е —А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤.
–Я–µ—А–µ–≤–∞–ґ–љ–∞ –±—Ц–ї—М—И—Ц—Б—В—М —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –љ–µ –Љ–∞—Ф —Б–њ–µ—Ж—Ц–∞–ї—М–љ–Є—Е –љ–∞–Ј–≤, –∞–ї–µ –і–ї—П —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –і–µ—П–Ї–Є—Е –µ–ї–µ–Љ–µ–љ—В—Ц–≤, –Ј–Њ–Ї—А–µ–Љ–∞ –і–ї—П —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –≤–Њ–і–љ—О, —Ц—Б–љ—Г—О—В—М —Б–њ–µ—Ж—Ц–∞–ї—М–љ—Ц –љ–∞–Ј–≤–Є —Ц –љ–∞–≤—Ц—В—М —Б–њ–µ—Ж—Ц–∞–ї—М–љ—Ц —Б–Є–Љ–≤–Њ–ї–Є. –Ґ–∞–Ї, —Ц–Ј–Њ—В–Њ–њ –≤–Њ–і–љ—О 1 H –љ–∞–Ј–Є–≤–∞—О—В—М –њ—А–Њ—В—Ц–є , —Ц–Ј–Њ—В–Њ–њ 2 H вАФ –і–µ–є—В–µ—А—Ц–є —Ц –њ–Њ–Ј–љ–∞—З–∞—О—В—М —Б–Є–Љ–≤–Њ–ї–Њ–Љ D, –∞ —Ц–Ј–Њ—В–Њ–њ 3 –Э вАФ —В—А–Є—В—Ц–є (—Б–Є–Љ–≤–Њ–ї T).
–Ф–µ—П–Ї—Ц —Ц–Ј–Њ—В–Њ–њ–Є –≤ –њ—А–Є—А–Њ–і—Ц –і–Њ—Б–Є—В—М –њ–Њ—И–Є—А–µ–љ—Ц, —П–Ї, –љ–∞–њ—А–Є–Ї–ї–∞–і, —Ц–Ј–Њ—В–Њ–њ –Ї–Є—Б–љ—О 16 O —В–∞ —Ц–Ј–Њ—В–Њ–њ –≤–Њ–і–љ—О 1 –Э, –∞ —Ц–љ—И—Ц —Ц–Ј–Њ—В–Њ–њ–Є –Ј—Г—Б—В—А—Ц—З–∞—О—В—М—Б—П –≤ –і—Г–ґ–µ –Љ—Ц–Ј–µ—А–љ–Є—Е –Ї—Ц–ї—М–Ї–Њ—Б—В—П—Е, —П–Ї —Ц–Ј–Њ—В–Њ–њ–Є –Ї–Є—Б–љ—О 17 O —Ц 18 O —Ц —Ц–Ј–Њ—В–Њ–њ–Є –≤–Њ–і–љ—О 2 H —Ц 3 H.
–Ч–∞ —Е—Ц–Љ—Ц—З–љ–Є–Љ–Є –≤–ї–∞—Б—В–Є–≤–Њ—Б—В—П–Љ–Є –≤—Б—Ц —Ц–Ј–Њ—В–Њ–њ–Є –Њ–Ї—А–µ–Љ–Њ–≥–Њ –µ–ї–µ–Љ–µ–љ—В—Г –і—Г–ґ–µ –±–ї–Є–Ј—М–Ї—Ц, —В–Њ–Љ—Г –Ј–љ–∞—З–љ–Њ—Ч —А—Ц–Ј–љ–Є—Ж—Ц –Љ—Ц–ґ –љ–Є–Љ–Є —Г —Е—Ц–Љ—Ц—З–љ–Є—Е —А–µ–∞–Ї—Ж—Ц—П—Е –љ–µ —Б–њ–Њ—Б—В–µ—А—Ц–≥–∞—Ф—В—М—Б—П. –Т–Є–љ—П—В–Њ–Ї —Б—В–∞–љ–Њ–≤–ї—П—В—М –ї–Є—И–µ —Ц–Ј–Њ—В–Њ–њ–Є –≤–Њ–і–љ—О, —П–Ї—Ц –Ј–∞ —Б–≤–Њ—Ч–Љ–Є –≤–ї–∞—Б—В–Є–≤–Њ—Б—В—П–Љ–Є –њ–Њ–Љ—Ц—В–љ–Њ –≤—Ц–і—А—Ц–Ј–љ—П—О—В—М—Б—П –Њ–і–Є–љ –≤—Ц–і –Њ–і–љ–Њ–≥–Њ.
–Р—В–Њ–Љ–љ–∞ –Љ–∞—Б–∞ —Ц–Ј–Њ—В–Њ–њ—Г –≤–Є—А–∞–ґ–µ–љ–∞ —Г –≤—Г–≥–ї–µ—Ж–µ–≤–Є—Е –Њ–і–Є–љ–Є—Ж—П—Е —Ц –љ–µ —Ф —Ж—Ц–ї–Є–Љ —З–Є—Б–ї–Њ–Љ –і–ї—П –≤—Б—Ц—Е –µ–ї–µ–Љ–µ–љ—В—Ц–≤ –Њ–Ї—А—Ц–Љ –° -12, –љ–∞ –≤—Ц–і–Љ—Ц–љ—Г –≤—Ц–і –Љ–∞—Б–Њ–≤–Њ–≥–Њ —З–Є—Б–ї–∞ , —П–Ї–µ —Ф –Ј–∞–≤–ґ–і–Є —Ж—Ц–ї–Є–Љ —З–Є—Б–ї–Њ–Љ , —А—Ц–≤–љ–Є–Љ —Б—Г–Љ—Ц –њ—А–Њ—В–Њ–љ—Ц–≤ —В–∞ –љ–µ–є—В—А–Њ–љ—Ц–≤.
–Ф—Ц–∞–≥—А–∞–Љ–∞, —Й–Њ –њ–Њ–Ї–∞–Ј—Г—Ф —А—Ц–Ј–љ—Ц —В–Є–њ–Є —А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ —А–Њ–Ј–њ–∞–і—Г. –У–Њ—А–Є–Ј–Њ–љ—В–∞–ї—М–љ–∞ –≤—Ц—Б—М - –∞—В–Њ–Љ–љ–Є–є –љ–Њ–Љ–µ—А, –≤–µ—А—В–Є–Ї–∞–ї—М–љ–∞ - –Ї—Ц–ї—М–Ї—Ц—Б—В—М –љ–µ–є—В—А–Њ–љ—Ц–≤ –§–Њ—В–Њ–њ–ї–∞—Б—В–Є–љ–Ї–∞ –Ф–ґ. –Ґ–Њ–Љ–њ—Б–Њ–љ–∞, —Г –љ–Є–ґ–љ—М–Њ–Љ—Г –њ—А–∞–≤–Њ–Љ—Г –Ї—Г—В—Ц —П–Ї–Њ—Ч –≤–Є–і–љ–Њ –њ–Њ–Ј–љ–∞—З–µ–љ–љ—П –і–≤–Њ—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –љ–µ–Њ–љ—Г, 20 —Ц 22. –Ф–Њ 20 —Б—В–Њ–ї—Ц—В—В—П –Ј–∞–≥–∞–ї—М–љ–Њ–њ—А–Є–є–љ—П—В–Њ—О –±—Г–ї–∞ –і—Г–Љ–Ї–∞, —Й–Њ –∞—В–Њ–Љ–љ–∞ –Љ–∞—Б–∞ –µ–ї–µ–Љ–µ–љ—В—Г —Ф –є–Њ–≥–Њ –њ–Њ—Б—В—Ц–є–љ–Њ—О —Ц –љ–µ–Ј–Љ—Ц–љ–љ–Њ—О —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Њ—О. –Я—А–Њ—В–µ, –Ј –≤—Ц–і–Ї—А–Є—В—В—П–Љ –љ–∞–њ—А–Є–Ї—Ц–љ—Ж—Ц 19 —Б—В–Њ–ї—Ц—В—В—П —А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ–Є—Е —А–µ—З–Њ–≤–Є–љ, —Ж–µ —Г—П–≤–ї–µ–љ–љ—П –њ–Њ—З–∞–ї–Њ –Ј–Љ—Ц–љ—О–≤–∞—В–Є—Б—П.
–Я—Ц–і —З–∞—Б —А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ —А–Њ–Ј–њ–∞–і—Г —Г—В–≤–Њ—А—О–≤–∞–ї–Є—Б—П –µ–ї–µ–Љ–µ–љ—В–Є, —Й–Њ, —З–µ—А–µ–Ј —Ч—Е —А—Ц–Ј–љ—Г –∞—В–Њ–Љ–љ—Г –Љ–∞—Б—Г, –≤–≤–∞–ґ–∞–ї–Є —А—Ц–Ј–љ–Є–Љ–Є, —Ц –і–∞–≤–∞–ї–Є —Ч–Љ –Њ–Ї—А–µ–Љ—Ц –љ–∞–Ј–≤–Є. –£ 1910 —А–Њ—Ж—Ц –§—А–µ–і–µ—А—Ц–Ї –°–Њ–і–і—Ц –њ–Њ–Ї–∞–Ј–∞–≤, —Й–Њ –Љ–µ–Ј–Њ—В–Њ—А—Ц–є (—В–Њ–і—Ц—И–љ—П –љ–∞–Ј–≤–∞ —А–∞–і—Ц—О-228), —А–∞–і—Ц–є (—А–∞–і—Ц–є-226 , –і–Њ–≤–≥–Њ–ґ–Є–≤—Г—З–Є–є —Ц–Ј–Њ—В–Њ–њ, —Й–Њ –Ј—Г—Б—В—А—Ц—З–∞—Ф—В—М—Б—П –≤ –њ—А–Є—А–Њ–і—Ц) —Ц —В–Њ—А—Ц–є-X (—А–∞–і—Ц–є-224) —Е—Ц–Љ—Ц—З–љ–Њ –љ–µ—А–Њ–Ј–і—Ц–ї—М–љ—Ц. –Р –≤ 1913 —А–Њ—Ж—Ц –≤—Ц–љ –ґ–µ –њ–Њ–Ї–∞–Ј–∞–≤, —Й–Њ –њ—Ц–і —З–∞—Б —А–Њ–Ј–њ–∞–і—Ц–≤ —А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ–Є—Е —А–µ—З–Њ–≤–Є–љ –љ–∞ –њ—А–Њ–Љ—Ц–ґ–Ї—Г –≤—Ц–і —Г—А–∞–љ—Г –і–Њ —Б–≤–Є–љ—Ж—О —Г—В–≤–Њ—А—О—Ф—В—М—Б—П –±–ї–Є–Ј—М–Ї–Њ 40 —А–∞–і—Ц–Њ–µ–ї–µ–Љ–µ–љ—В—Ц–≤ –Ј —А—Ц–Ј–љ–Њ—О –Љ–∞—Б–Њ—О, —В–Њ–і—Ц —П–Ї —Г —В–∞–±–ї–Є—Ж—Ц –Ь–µ–љ–і–µ–ї—Ф—Ф–≤–∞ –Љ—Ц–ґ —Ж–Є–Љ–Є –µ–ї–µ–Љ–µ–љ—В–∞–Љ–Є –Љ–Њ–ґ–µ —А–Њ–Ј–Љ—Ц—Й—Г–≤–∞—В–Є—Б—М –љ–µ –±—Ц–ї—М—И —П–Ї 11 —Ц–љ—И–Є—Е.
–Ґ–Њ–≥–Њ —Б–∞–Љ–Њ–≥–Њ —А–Њ–Ї—Г –°–Њ–і–і—Ц –є –Ъ–∞–Ј–Є–Љ—Ц—А –§–∞—П–љ—Б –Ј–∞–њ—А–Њ–њ–Њ–љ—Г–≤–∞–ї–Є –Ј–∞–Ї–Њ–љ —А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ–Є—Е –Ј–Љ—Ц—Й–µ–љ—М , –Ј–≥—Ц–і–љ–Њ –Ј —П–Ї–Є–Љ –∞–ї—М—Д–∞-—А–Њ–Ј–њ–∞–і –Ј–Љ—Ц—Й—Г—Ф –µ–ї–µ–Љ–µ–љ—В —Г —В–∞–±–ї–Є—Ж—Ц –љ–∞ –і–≤—Ц –њ–Њ–Ј–Є—Ж—Ц—Ч –≤–ї—Ц–≤–Њ, –Ј–Љ–µ–љ—И—Г—О—З–Є –є–Њ–≥–Њ –Љ–∞—Б—Г –љ–∞ 4, —В–Њ–і—Ц —П–Ї –±–µ—В–∞-—А–Њ–Ј–њ–∞–і вАФ –љ–∞ –Њ–і–љ—Г –њ–Њ–Ј–Є—Ж—Ц—О –≤–њ—А–∞–≤–Њ, –Ј–∞–ї–Є—И–∞—О—З–Є –Љ–∞—Б—Г –љ–µ–Ј–Љ—Ц–љ–љ–Њ—О. –Ґ–∞–Ї–Є–Љ —З–Є–љ–Њ–Љ, –∞–ї—М—Д–∞-—А–Њ–Ј–њ–∞–і, —Й–Њ —Б—Г–њ—А–Њ–≤–Њ–і–ґ—Г—Ф—В—М—Б—П –і–≤–Њ–Љ–∞ –±–µ—В–∞-—А–Њ–Ј–њ–∞–і–∞–Љ–Є, –њ–Њ—А–Њ–і–ґ—Г—Ф –µ–ї–µ–Љ–µ–љ—В, —Й–Њ –љ–µ –≤—Ц–і—А—Ц–Ј–љ—П—Ф—В—М—Б—П –≤—Ц–і –Љ–∞—В–µ—А–Є–љ—Б—М–Ї–Њ–≥–Њ —Е—Ц–Љ—Ц—З–љ–Њ, –њ—А–Њ—В–µ –Љ–∞—Ф –Љ–µ–љ—И—Г –∞—В–Њ–Љ–љ—Г –Љ–∞—Б—Г.
–°–∞–Љ —В–µ—А–Љ—Ц–љ "—Ц–Ј–Њ—В–Њ–њ", —Й–Њ –Ј –≥—А–µ—Ж—М–Ї–Њ—Ч –Љ–Њ–ґ–љ–∞ –њ–µ—А–µ–Ї–ї–∞—Б—В–Є —П–Ї "–≤ —В–Њ–Љ—Г —Б–∞–Љ–Њ–Љ—Г –Љ—Ц—Б—Ж—Ц", –°–Њ–і–і—Ц –њ—Ц–і–Ї–∞–Ј–∞–ї–∞ —И–Њ—В–ї–∞–љ–і—Б—М–Ї–Є–є —Д—Ц–Ј–Є–Ї –Ь–∞—А–≥–∞—А–µ—В –Ґ–Њ–і–і –њ—Ц–і —З–∞—Б –±–µ—Б—Ц–і–Є, —Г —П–Ї—Ц–є —В–Њ–є –њ–Њ–і—Ц–ї–Є–≤—Б—П –Ј –љ–µ—О —Б–≤–Њ—Ч–Љ–Є —Ц–і–µ—П–Љ–Є.[ 1]
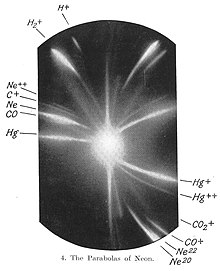
–Я—Ц–Ј–љ—Ц—И–µ –±—Г–ї–Є –≤—Ц–і–Ї—А–Є—В–Њ, —Й–Њ –і–µ—П–Ї—Ц –љ–µ—А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ—Ц –µ–ї–µ–Љ–µ–љ—В–Є —Ф —Б—Г–Љ—Ц—И—И—О –Ї—Ц–ї—М–Ї–Њ—Е —Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤. –Я–µ—А—И–Є–Љ –µ–ї–µ–Љ–µ–љ—В–Њ–Љ, –і–ї—П —П–Ї–Њ–≥–Њ –±—Г–ї–Є –≤—Ц–і–Ї—А–Є—В—Ц —В–∞–Ї—Ц —Ц–Ј–Њ—В–Њ–њ–Є –±—Г–≤ –љ–µ–Њ–љ: —Г 1913 —А–Њ—Ж—Ц –Ф–ґ–Њ–Ј–µ—Д –Ґ–Њ–Љ–њ—Б–Њ–љ –њ–Њ–Ї–∞–Ј–∞–≤, —Й–Њ —Г –њ—А–Є—А–Њ–і–љ–Њ–Љ—Г –љ–µ–Њ–љ—Ц –њ—А–Є—Б—Г—В–љ—Ц –і–≤—Ц —Д—А–∞–Ї—Ж—Ц—Ч –Ј –∞—В–Њ–Љ–љ–Є–Љ–Є –Љ–∞—Б–∞–Љ–Є 20 —Ц 22. –Ч —А–Њ–Ј–≤–Є—В–Ї–Њ–Љ –Љ–∞—Б-—Б–њ–µ–Ї—В—А–Њ–Љ–µ—В—А—Ц—Ч –≤–Є—П–≤–ї—П—В–Є —В–∞–Ї—Ц —Ц–Ј–Њ—В–Њ–њ–Є —Б—В–∞–ї–Њ –њ—А–Њ—Б—В—Ц—И–µ. –£ 1919 —А–Њ—Ж—Ц –§—А–µ–љ—Б—Ц—Б –Р—Б—В–Њ–љ –≤—Ц–і–Ї—А–Є–≤ –≤–µ–ї–Є–Ї—Г –Ї—Ц–ї—М–Ї—Ц—Б—В—М –µ–ї–µ–Љ–µ–љ—В—Ц–≤, —Й–Њ –Љ–∞—О—В—М –Ї—Ц–ї—М–Ї–∞ —Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤. –Ъ—А—Ц–Љ —В–Њ–≥–Њ, –Р—Б—В–Њ–љ –њ–Њ–Ї–∞–Ј–∞–≤, —Й–Њ —Г—Б—Ц —Ц–Ј–Њ—В–Њ–њ–Є –Љ–∞—О—В—М –∞—В–Њ–Љ–љ—Ц –Љ–∞—Б–Є –њ—А–Њ–њ–Њ—А—Ж—Ц–є–љ—Ц –і–Њ –∞—В–Њ–Љ–љ–Њ—Ч –Љ–∞—Б–Є –≤–Њ–і–љ—О, –∞ –µ–ї–µ–Љ–µ–љ—В–Є, –∞—В–Њ–Љ–љ–∞ –Љ–∞—Б–∞ —П–Ї–Є—Е –≤—Ц–і—Е–Є–ї—П—Ф—В—М—Б—П –≤—Ц–і —Ж—М–Њ–≥–Њ –њ—А–∞–≤–Є–ї–∞, —Ф —Б—Г–Љ—Ц—И–∞–Љ–Є —Ц–Ј–Њ—В–Њ–њ—Ц–≤. –Э–∞–њ—А–Є–Ї–ї–∞–і, —Е–ї–Њ—А —Г –њ—А–Є—А–Њ–і—Ц —Ц—Б–љ—Г—Ф —Г –≤–Є–≥–ї—П–і—Ц –і–≤–Њ—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –Ј –Љ–∞—Б–∞–Љ–Є 35 —Ц 37, –∞ –є–Њ–≥–Њ –∞—В–Њ–Љ–љ–∞ –Љ–∞—Б–∞, —Й–Њ –≤–≤–∞–ґ–∞–ї–∞—Б—П —А—Ц–≤–љ–Њ—О 35.45, –љ–∞—Б–њ—А–∞–≤–і—Ц —Ф —Б–µ—А–µ–і–љ—Ц–Љ –Ј–≤–∞–ґ–µ–љ–Є–Љ –Љ–∞—Б —Ж–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ (–≤—Ц–і–њ–Њ–≤—Ц–і–љ–Њ –і–Њ —Ч—Е —З–∞—Б—В–Њ–Ї —Г –њ—А–Є—А–Њ–і–љ–Њ–Љ—Г —Е–ї–Њ—А—Ц).[ 2]
–Ж –§—А–µ–і–µ—А—Ц–Ї –°–Њ–і–і—Ц —Ц –§—А–µ–љ—Б—Ц—Б –Р—Б—В–Њ–љ –Ј–∞ —Б–≤–Њ—Ч —А–Њ–±–Њ—В–Є –Ј –≤—Ц–і–Ї—А–Є—В—В—П —Ц –і–Њ—Б–ї—Ц–і–ґ–µ–љ–љ—П —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –Њ—В—А–Є–Љ–∞–ї–Є –љ–Њ–±–µ–ї—Ц–≤—Б—М–Ї—Ц –њ—А–µ–Љ—Ц—Ч –Ј —Е—Ц–Љ—Ц—Ч , —Г 1921 —Ц 1922 —А–Њ—Ж—Ц –≤—Ц–і–њ–Њ–≤—Ц–і–љ–Њ.[ 3]
–£ 1932 —А–Њ—Ж—Ц –±—Г–≤ –≤—Ц–і–Ї—А–Є—В–Є–є –љ–µ–є—В—А–Њ–љ , —Ц –Ј–≥–Њ–і–Њ–Љ —Б—В–∞–ї–Њ –Ј—А–Њ–Ј—Г–Љ—Ц–ї–Њ, —Й–Њ —Б–∞–Љ–µ —А—Ц–Ј–љ–∞ –Ї—Ц–ї—М–Ї—Ц—Б—В—М –љ–µ–є—В—А–Њ–љ—Ц–≤ —Г —П–і—А—Ц –≤—Ц–і—А—Ц–Ј–љ—П—Ф —Ц–Ј–Њ—В–Њ–њ–Є –Њ–і–Є–љ –≤—Ц–і –Њ–і–љ–Њ–≥–Њ. –£ 1934 —А–Њ—Ж—Ц –§—А–µ–і–µ—А—Ц–Ї —В–∞ –Ж—А–µ–љ –Ц–Њ–ї—Ц–Њ-–Ъ—О—А—Ц –≤–Є—П–≤–Є–ї–Є, —Й–Њ –њ—А–Є –±–Њ–Љ–±–∞—А–і—Г–≤–∞–љ–љ—Ц –ї–µ–≥–Ї–Є—Е –µ–ї–µ–Љ–µ–љ—В—Ц–≤ –∞–ї—М—Д–∞-—З–∞—Б—В–Є–љ–Ї–∞–Љ–Є —Г—В–≤–Њ—А—О—О—В—М—Б—П –Ї–Њ—А–Њ—В–Ї–Њ–ґ–Є–≤—Г—З—Ц —Ц–Ј–Њ—В–Њ–њ–Є –і–µ—П–Ї–Є—Е –ї–µ–≥–Ї–Є—Е –µ–ї–µ–Љ–µ–љ—В—Ц–≤, –∞ —А–Њ–Ј–њ–∞–і —В–∞–Ї–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —Ц–і–µ –њ–Њ –љ–µ–≤—Ц–і–Њ–Љ–Њ–Љ—Г —А–∞–љ—Ц—И–µ –Ї–∞–љ–∞–ї—Г (ќ≤+), —Ц —Б—Г–њ—А–Њ–≤–Њ–і–ґ—Г—Ф—В—М—Б—П –µ–Љ—Ц—Б—Ц—Ф—О –њ–Њ–Ј–Є—В—А–Њ–љ—Ц–≤[ 4] –Х–љ—А—Ц–Ї–Њ –§–µ—А–Љ—Ц –њ–Њ–Ї–∞–Ј–∞–≤, —Й–Њ –Њ–њ—А–Њ–Љ—Ц–љ–µ–љ–љ—П —Б—В–∞–±—Ц–ї—М–љ–Є—Е –µ–ї–µ–Љ–µ–љ—В—Ц–≤ –љ–µ–є—В—А–Њ–љ–∞–Љ–Є –њ—А–Є–Ј–≤–Њ–і–Є—В—М –і–Њ —Ч—Е –Ј–∞—Е–Њ–њ–ї–µ–љ–љ—П —П–і—А–∞–Љ–Є, —Ц —Г—В–≤–Њ—А–µ–љ–љ—П –љ–Њ–≤–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —Ж–Є—Е –ґ–µ –µ–ї–µ–Љ–µ–љ—В—Ц–≤. –£—Б—Ц —Ж—Ц —П–≤–Є—Й–∞ –Њ—В—А–Є–Љ–∞–ї–Є –љ–∞–Ј–≤—Г —И—В—Г—З–љ–∞ —А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ—Ц—Б—В—М . –Ч–∞ –і–Њ–њ–Њ–Љ–Њ–≥–Њ—О —В–∞–Ї–Є—Е –Љ–µ—В–Њ–і—Ц–≤ —Д—Ц–Ј–Є–Ї–Є –Њ—В—А–Є–Љ–∞–ї–Є –Љ–Њ–ґ–ї–Є–≤—Ц—Б—В—М —Б—В–≤–Њ—А—О–≤–∞—В–Є –≤–µ–ї–Є–Ї—Г –Ї—Ц–ї—М–Ї—Ц—Б—В—М –љ–µ—Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤.
–С—Ц–ї—М—И—Ц—Б—В—М –≤—Ц–і–Њ–Љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –љ–µ—Б—В–∞–±—Ц–ї—М–љ—Ц —Й–Њ–і–Њ —А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ —А–Њ–Ј–њ–∞–і—Г. –•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ–Є –љ–µ—Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —Ф –њ–µ—А—Ц–Њ–і –љ–∞–њ—Ц–≤—А–Њ–Ј–њ–∞–і—Г —В–∞ –Ї–∞–љ–∞–ї —А–Њ–Ј–њ–∞–і—Г. –Ю—Б–љ–Њ–≤–љ–Є–Љ–Є –Ї–∞–љ–∞–ї–∞–Љ–Є —А–Њ–Ј–њ–∞–і—Г —Ф –±–µ—В–∞-—А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ—Ц—Б—В—М —В–∞ –∞–ї—М—Д–∞-—А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ—Ц—Б—В—М. –Я—А–Є –±–µ—В–∞-—А–Њ–Ј–њ–∞–і—Ц —П–і—А–Њ —Ц–Ј–Њ—В–Њ–њ—Г –≤–Є–њ—А–Њ–Љ—Ц–љ—О—Ф –µ–ї–µ–Ї—В—А–Њ–љ –∞–±–Њ –њ–Њ–Ј–Є—В—А–Њ–љ —Ц, –≤—Ц–і–њ–Њ–≤—Ц–і–љ–Њ, –∞–±–Њ –Ј–±—Ц–ї—М—И—Г—Ф, –∞–±–Њ –Ј–Љ–µ–љ—И—Г—Ф —Б–≤—Ц–є –∞—В–Њ–Љ–љ–Є–є –љ–Њ–Љ–µ—А . –Я—А–Є –∞–ї—М—Д–∞-—А–Њ–Ј–њ–∞–і—Ц —П–і—А–Њ —Ц–Ј–Њ—В–Њ–њ—Г –≤–Є–њ—А–Њ–Љ—Ц–љ—О—Ф –∞–ї—М—Д–∞-—З–∞—Б—В–Є–љ–Ї—Г, —Ц –≤—Ц–і–њ–Њ–≤—Ц–і–љ–Њ, –є–Њ–≥–Њ –∞—В–Њ–Љ–љ–Є–є –љ–Њ–Љ–µ—А –Ј–Љ–µ–љ—И—Г—Ф—В—М—Б—П –љ–∞ –і–≤—Ц–є–Ї—Г, –∞ –Љ–∞—Б–Њ–≤–µ —З–Є—Б–ї–Њ –љ–∞ 4. –Ф–µ—П–Ї—Ц —Ц–Ј–Њ—В–Њ–њ–Є, –љ–∞–њ—А–Є–Ї–ї–∞–і, 235 U, –Љ–Њ–ґ—Г—В—М –і—Ц–ї–Є—В–Є—Б—П .
–Я–µ—А—Ц–Њ–і –љ–∞–њ—Ц–≤—А–Њ–Ј–њ–∞–і—Г –љ–µ—Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –Љ–Њ–ґ–µ –±—Г—В–Є –і—Г–ґ–µ —А—Ц–Ј–љ–Є–Љ, –≤—Ц–і 1√Ч 10-24 c –і–Њ –Ј–љ–∞—З–µ–љ—М, —Й–Њ –њ–µ—А–µ–≤–Є—Й—Г—О—В—М –≤—Ц–Ї –Т—Б–µ—Б–≤—Ц—В—Г. –Т –Њ—Б—В–∞–љ–љ—М–Њ–Љ—Г –≤–Є–њ–∞–і–Ї—Г —Б–ї–∞–±–Ї—Г —А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ—Ц—Б—В—М –Љ–Њ–ґ–љ–∞ –Ј–∞—А–µ—Ф—Б—В—А—Г–≤–∞—В–Є —В–Њ—З–љ–Є–Љ–Є –≤–Є–Љ—Ц—А—О–≤–∞–љ–љ—П–Љ–Є, –Њ–і–љ–∞–Ї —Ц–Ј–Њ—В–Њ–њ –Љ–Њ–ґ–љ–∞ –≤–≤–∞–ґ–∞—В–Є –њ—А–∞–Ї—В–Є—З–љ–Њ —Б—В–∞–±—Ц–ї—М–љ–Є–Љ.
–Т –љ–∞–≤–Ї–Њ–ї–Є—И–љ—Ц–є –њ—А–Є—А–Њ–і—Ц –Ј—Г—Б—В—А—Ц—З–∞—О—В—М—Б—П –Ј–і–µ–±—Ц–ї—М—И–Њ–≥–Њ —Б—В–∞–±—Ц–ї—М–љ—Ц —Ц–Ј–Њ—В–Њ–њ–Є —Е—Ц–Љ—Ц—З–љ–Є—Е –µ–ї–µ–Љ–µ–љ—В—Ц–≤, –Њ—Б–Ї—Ц–ї—М–Ї–Є –љ–µ—Б—В–∞–±—Ц–ї—М–љ—Ц –≤—А–µ—И—В—Ц-—А–µ—И—В —А–Њ–Ј–њ–∞–і–∞—О—В—М—Б—П. –Ю–і–љ–∞–Ї –≤–Њ–љ–Є —В–∞–Ї–Њ–ґ —Ц —Г—В–≤–Њ—А—О—О—В—М—Б—П –≤–љ–∞—Б–ї—Ц–і–Њ–Ї —П–і–µ—А–љ–Є—Е —А–µ–∞–Ї—Ж—Ц–є .
–Ч–∞–≥–∞–ї–Њ–Љ, —Ц—Б–љ—Г—Ф 254 —Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ–Є, —Й–Њ –љ–∞–ї–µ–ґ–∞—В—М 81 –µ–ї–µ–Љ–µ–љ—В—Г, –њ—А–Є —В–Њ–Љ—Г, —Й–Њ –Ј–∞–≥–∞–ї–Њ–Љ –≤—Ц–і–Њ–Љ–Њ 3339 —А—Ц–Ј–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤[ 5]
–†–Њ–Ј–њ–Њ–і—Ц–ї –µ–ї–µ–Љ–µ–љ—В—Ц–≤ –Ј–∞ –Ї—Ц–ї—М–Ї—Ц—Б—В—О —Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —В–∞–Ї–Є–є:[ 6]
10 —Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ вАФ 1 –µ–ї–µ–Љ–µ–љ—В (–Њ–ї–Њ–≤–Њ )
8 —Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ вАФ 1 –µ–ї–µ–Љ–µ–љ—В (–Ї—Б–µ–љ–Њ–љ )
7 —Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —Г —З–Њ—В–Є—А—М–Њ—Е –µ–ї–µ–Љ–µ–љ—В—Ц–≤
6 —Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –Љ–∞—О—В—М –≤—Ц—Б—Ц–Љ –µ–ї–µ–Љ–µ–љ—В—Ц–≤
5 —Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –Љ–∞—О—В—М –і–µ—Б—П—В—М –µ–ї–µ–Љ–µ–љ—В—Ц–≤
4 —Б—В–∞–±—Ц–ї—М–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ–Є —Ф —Г –і–µ–≤'—П—В–Є –µ–ї–µ–Љ–µ–љ—В—Ц–≤
—В—А–Є —Б—В–∞–±—Ц–ї—М–љ—Ц —Ц–Ј–Њ—В–Њ–њ–Є —Ф —Г –њ'—П—В–Є –µ–ї–µ–Љ–µ–љ—В—Ц–≤
16 –µ–ї–µ–Љ–µ–љ—В—Ц–≤ –Љ–∞—О—В—М –і–≤–∞ —Б—В–∞–±—Ц–ї—М–љ—Ц —Ц–Ј–Њ—В–Њ–њ–Є, —А–∞—Е—Г—О—З–Є –Љ–µ—В–∞—Б—В–∞–±—Ц–ї—М–љ–Є–є –Ј–±—Г–і–ґ–µ–љ–Є–є —Б—В–∞–љ —В–∞–љ—В–∞–ї—Г -180m
26 –µ–ї–µ–Љ–µ–љ—В—Ц–≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Ц –ї–Є—И–µ –Њ–і–љ–Є–Љ –љ—Г–Ї–ї—Ц–і–Њ–Љ
–£ –±–∞–≥–∞—В—М–Њ—Е –≥–∞–ї—Г–Ј—П—Е –≤–Є–Ї–Њ—А–Є—Б—В–Њ–≤—Г—О—В—М—Б—П —А–µ—З–Њ–≤–Є–љ–Є –Ј—Ц –Ј–Љ—Ц—Й–µ–љ–Є–Љ —Ц–Ј–Њ—В–Њ–њ–љ–Є–Љ —Б–Ї–ї–∞–і–Њ–Љ. –Т –њ–µ—А—И—Г —З–µ—А–≥—Г —Ж–µ —Б—В–Њ—Б—Г—Ф—В—М—Б—П —Г—А–∞–љ—Г, —А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ–Є–є –љ—Г–Ї–ї—Ц–і —П–Ї–Њ–≥–Њ (–Ј –∞—В–Њ–Љ–љ–Њ—О –Љ–∞—Б–Њ—О 235), —Ф –≤–Ї—А–∞–є –≤–ґ–Є–≤–∞–љ–Є–Љ —Г –≤–Є—А–Њ–±–љ–Є—Ж—В–≤—Ц –Ј–±—А–Њ—Ч, —П–і–µ—А–љ—Ц–є –µ–љ–µ—А–≥–µ—В–Є—Ж—Ц, —В–Њ—Й–Њ. –Ч–∞–≥–∞–ї–Њ–Љ, –њ—А–Њ–±–ї–µ–Љ–∞ —А–Њ–Ј–і—Ц–ї–µ–љ–љ—П —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —Ф –≤–Ї—А–∞–є —Б–Ї–ї–∞–і–љ–Њ—О, —З–µ—А–µ–Ј —В–µ, —Й–Њ —Е—Ц–Љ—Ц—З–љ–Њ –≤–Њ–љ–Є –њ—А–∞–Ї—В–Є—З–љ–Њ –µ–Ї–≤—Ц–≤–∞–ї–µ–љ—В–љ—Ц.
–Ж—Б–љ—Г—Ф –і–≤—Ц –≤–µ–ї–Є–Ї–Є—Е –≥—А—Г–њ–Є –Љ–µ—В–Њ–і—Ц–≤ —А–Њ–Ј–і—Ц–ї–µ–љ–љ—П —Ц–Ј–Њ—В–Њ–њ—Ц–≤: –∞–±—Б–Њ–ї—О—В–љ—Ц –Љ–µ—В–Њ–і–Є, —П–Ї—Ц –і–Њ–Ј–≤–Њ–ї—П—О—В—М –≤–Є–і—Ц–ї–Є—В–Є —Ц–Ј–Њ—В–Њ–њ–Є –≤ —З–Є—Б—В–Њ–Љ—Г –≤–Є–≥–ї—П–і—Ц, –∞ —В–∞–Ї–Њ–ґ –Љ–µ—В–Њ–і–Є, —Й–Њ –ї–Є—И–µ –Ј–±—Ц–ї—М—И—Г—О—В—М –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж—Ц—О –і–µ—П–Ї–Њ–≥–Њ –љ—Г–Ї–ї—Ц–і—Г.
–Ф–Њ –∞–±—Б–Њ–ї—О—В–љ–Є—Е –Љ–µ—В–Њ–і—Ц–≤ –≤—Ц–і–љ–Њ—Б—П—В—М:
–Х–ї–µ–Ї—В—А–Њ–Љ–∞–≥–љ—Ц—В–љ–µ —А–Њ–Ј–і—Ц–ї–µ–љ–љ—П: —Б—Г–Љ—Ц—И —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –≤–Є–њ–∞—А–Њ–≤—Г—О—В—М —Ц —Ц–Њ–љ—Ц–Ј—Г—О—В—М, –њ—А–Є—Б–Ї–Њ—А—О—О—В—М –µ–ї–µ–Ї—В—А–Є—З–љ–Є–Љ –њ–Њ–ї–µ–Љ, –њ—Ц—Б–ї—П —З–Њ–≥–Њ –Ј–∞–њ—Г—Б–Ї–∞—О—В—М –≤ –Ї–∞–Љ–µ—А—Г –Ј –Љ–∞–≥–љ—Ц—В–љ–Є–Љ –њ–Њ–ї–µ–Љ, –њ–µ—А–њ–µ–љ–і–Є–Ї—Г–ї—П—А–љ–Є–Љ –љ–∞–њ—А—П–Љ–Ї—Г —А—Г—Е—Г —Ц–Њ–љ—Ц–≤. –Ґ–∞–Ї–Є–Љ —З–Є–љ–Њ–Љ, –≤—Ц–і—Е–Є–ї–µ–љ–љ—П –Њ–Ї—А–µ–Љ–Є—Е –∞—В–Њ–Љ—Ц–≤ —Г –њ–Њ–ї—Ц —Ф –њ—А–Њ–њ–Њ—А—Ж—Ц–є–љ–Є–Љ –≤—Ц–і–љ–Њ—И–µ–љ–љ—О m/z (—П–Ї–µ —Ф —А—Ц–Ј–љ–Є–Љ –і–ї—П —А—Ц–Ј–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤), —Ц —Б—Г–Љ—Ц—И —А–Њ–Ј–і—Ц–ї—П—Ф—В—М—Б—П –љ–∞ –Њ–Ї—А–µ–Љ—Ц –њ—Г—З–Ї–Є —Ц–Ј–Њ—В–Њ–њ—Ц–≤, —Й–Њ –≤–ї–Њ–≤–ї—О—О—В—М—Б—П —Ц –≤—Ц–і–Њ–Ї—А–µ–Љ–ї—О—О—В—М—Б—П.
–Ы–∞–Ј–µ—А–љ–µ —А–Њ–Ј–і—Ц–ї–µ–љ–љ—П, —Й–Њ –њ—А–∞—Ж—О—Ф –Ј–∞–≤–і—П–Ї–Є —В–Њ–Љ—Г, —Й–Њ –Љ–Њ–ї–µ–Ї—Г–ї–Є, —Й–Њ –Љ—Ц—Б—В—П—В—М —А—Ц–Ј–љ—Ц —Ц–Ј–Њ—В–Њ–њ–Є, –Ј–±—Г–і–ґ—Г—О—В—М—Б—П –њ—Ц–і –і—Ц—Ф—О —Б–≤—Ц—В–ї–∞ —А—Ц–Ј–љ–Њ—Ч —З–∞—Б—В–Њ—В–Є. –Я–Њ—В—Ц–Љ –Ј–±—Г–і–ґ–µ–љ—Ц –Љ–Њ–ї–µ–Ї—Г–ї–Є –≤—Ц–і–Њ–Ї—А–µ–Љ–ї—О—О—В—М—Б—П –µ–ї–µ–Ї—В—А–Є—З–љ–Є–Љ –њ–Њ–ї–µ–Љ —З–Є –±—Г–і—М-—П–Ї–Є–Љ —Ц–љ—И–Є–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ. –Я—А–Њ—В–µ, —Е–Њ—З–∞ –∞–±—Б–Њ–ї—О—В–љ–µ —А–Њ–Ј–і—Ц–ї–µ–љ–љ—П –Ј–і–∞—Ф—В—М—Б—П –±—Ц–ї—М—И –µ—Д–µ–Ї—В–Є–≤–љ–Є–Љ, —З–µ—А–µ–Ј –≤–µ–ї–Є–Ї—Г –≤–∞—А—В—Ц—Б—В—М, –≤ –њ—А–Њ–Љ–Є—Б–ї–Њ–≤–Є—Е –Љ–∞—Б—И—В–∞–±–∞—Е –≤–Њ–љ–Њ –≤–Є–Ї–Њ—А–Є—Б—В–Њ–≤—Г—Ф—В—М—Б—П –њ–Њ—А—Ц–≤–љ—П–љ–Њ —А—Ц–і—И–µ.
–Э–∞—В–Њ–Љ—Ц—Б—В—М –Ј–∞—Б—В–Њ—Б–Њ–≤—Г—Ф—В—М—Б—П –≤–µ–ї–Є–Ї–∞ –Ї—Ц–ї—М–Ї—Ц—Б—В—М –Љ–µ—В–Њ–і—Ц–≤, —Й–Њ –љ–µ–љ–∞–±–∞–≥–∞—В–Њ –Ј–Љ—Ц—Й—Г—Ф –њ—А–Њ–њ–Њ—А—Ж—Ц—Ч —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —Г –Ј—А–∞–Ј–Ї—Г. –Ф–ї—П —В–Њ–≥–Њ, —Й–Њ–± –Њ—В—А–Є–Љ–∞—В–Є –њ–Њ—А—Ц–≤–љ—П–љ–Њ —З–Є—Б—В–Є–є —Ц–Ј–Њ—В–Њ–њ, —Ж—Ц –Љ–µ—В–Њ–і–Є —В—А–µ–±–∞ –Ј–∞—Б—В–Њ—Б–Њ–≤—Г–≤–∞—В–Є –±–∞–≥–∞—В–Њ —А–∞–Ј—Ц–≤. –©–Њ–± –Њ—Ж—Ц–љ–Є—В–Є –µ—Д–µ–Ї—В–Є–≤–љ—Ц—Б—В—М —А–Њ–Ј–і—Ц–ї–µ–љ–љ—П, –≤–Є–Ї–Њ—А–Є—Б—В–Њ–≤—Г—Ф—В—М—Б—П –њ–Њ–Ї–∞–Ј–љ–Є–Ї, —Й–Њ –љ–∞–Ј–Є–≤–∞—Ф—В—М—Б—П –Ї–Њ–µ—Д—Ц—Ж—Ц—Ф–љ—В —Б–µ–њ–∞—А–∞—Ж—Ц—Ч , —Й–Њ —А–Њ–Ј—А–∞—Е–Њ–≤—Г—Ф—В—М—Б—П —П–Ї
α ќ± -->
=
N
1
1
− вИТ -->
N
1
N
2
1
− вИТ -->
N
2
{\displaystyle \alpha ={\frac {\frac {N_{1}}{1-N_{1}}}{\frac {N_{2}}{1-N_{2}}}}}
1 —Ц N2 вАФ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж—Ц—Ч —Ц–Ј–Њ—В–Њ–њ—Г, —Й–Њ –≤–Є–і—Ц–ї—П—Ф—В—М—Б—П, —Г –Ј–±–∞–≥–∞—З–µ–љ—Ц–є —Ц —Г –Ј–±—Ц–і–љ–µ–љ—Ц–є —Д—А–∞–Ї—Ж—Ц—Ч. –°–µ—А–µ–і –Љ–µ—В–Њ–і—Ц–≤ —В–∞–Ї–Њ–≥–Њ —В–Є–њ—Г –Љ–Њ–ґ–љ–∞ –≤—Ц–і–Љ—Ц—В–Є—В–Є —В–∞–Ї—Ц[ 7]
–У–∞–Ј–Њ–≤–∞ –і–Є—Д—Г–Ј—Ц—П : —И–≤–Є–і–Ї–Њ—Б—В—Ц –Љ–Њ–ї–µ–Ї—Г–ї –ї–µ–≥–Ї–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ –±—Ц–ї—М—И—Ц, –љ—Ц–ґ –≤–∞–ґ–Ї–Є—Е, —В–Њ–Љ—Г –њ—А–Є –њ—А–Њ–њ—Г—Б–Ї–∞–љ–љ—Ц —З–µ—А–µ–Ј –Љ–µ–Љ–±—А–∞–љ—Г –≥–∞–Ј—Г, —Й–Њ —Б–Ї–ї–∞–і–∞—Ф—В—М—Б—П –Ј —Б—Г–Љ—Ц—И—Ц —Ц–Ј–Њ—В–Њ–њ—Ц–≤, –ї–µ–≥–Ї—Ц —Ц–Ј–Њ—В–Њ–њ–Є –њ—А–Њ—Е–Њ–і—П—В—М —И–≤–Є–і—И–µ.
–Ґ–µ—А–Љ–Њ–і–Є—Д—Г–Ј—Ц—П: –њ—А–Є —Ц—Б–љ—Г–≤–∞–љ–љ—Ц –≥—А–∞–і—Ц—Ф–љ—В—Г —В–µ–Љ–њ–µ—А–∞—В—Г—А–Є —Г —А—Ц–і–Є–љ—Ц —З–Є –≥–∞–Ј—Ц –∞—В–Њ–Љ–Є –ї–µ–≥–Ї–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —З–∞—Б—В—Ц—И–µ –Њ–њ–Є–љ—П—О—В—М—Б—П —Г –±—Ц–ї—М—И —В–µ–њ–ї–Є—Е –Љ—Ц—Б—Ж—П—Е, —В–Њ–Љ—Г —Г —Ж–Є—Е –Ј–Њ–љ–∞—Е —Ч—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж—Ц—П –њ—Ц–і–≤–Є—Й—Г—Ф—В—М—Б—П.
–Ф–Є—Б—В–Є–ї—П—Ж—Ц—П: –њ—А–Є –њ–µ—А–µ–≤–µ–і–µ–љ–љ—Ц —А–µ—З–Њ–≤–Є–љ–Є —Г —Б—В–∞–љ —А—Ц–≤–љ–Њ–≤–∞–≥–Є –Љ—Ц–ґ —А—Ц–і–Є–љ–Њ—О —Ц –њ–∞—А–Њ—О –ї–µ–≥–Ї–Є–є —Ц–Ј–Њ—В–Њ–њ –Ї–Њ–љ—Ж–µ–љ—В—А—Г—Ф—В—М—Б—П –≤ –њ–∞—А—Ц.
–У–∞–Ј–Њ–≤—Ц —Ж–µ–љ—В—А–Є—Д—Г–≥–Є : –њ—А–Є —А–Њ–Ј–Ї—А—Г—З–µ–љ–љ—Ц –≥–∞–Ј–Њ–≤–Њ—Ч —Б—Г–Љ—Ц—И—Ц —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —Г —Ж–µ–љ—В—А–Є—Д—Г–Ј—Ц –ї–µ–≥–Ї—Ц —Ц–Ј–Њ—В–Њ–њ–Є –Ї–Њ–љ—Ж–µ–љ—В—А—Г—О—В—М—Б—П –±—Ц–ї—П –Њ—Б—Ц.
–Ж–Ј–Њ—В–Њ–њ–љ–Є–є –Њ–±–Љ—Ц–љ : –њ—А–Є –Ї–Њ–љ—В–∞–Ї—В—Ц –і–≤–Њ—Е —А—Ц–Ј–љ–Є—Е —Б–њ–Њ–ї—Г–Ї —А–Њ–Ј–і—Ц–ї—О–≤–∞–љ–Њ–≥–Њ –µ–ї–µ–Љ–µ–љ—В—Г, —Й–Њ –њ–µ—А–µ–±—Г–≤–∞—О—В—М —Г —А—Ц–Ј–љ–Є—Е —Д–∞–Ј–∞—Е, —А—Ц–Ј–љ—Ц —Ц–Ј–Њ—В–Њ–њ–Є –Ї–Њ–љ—Ж–µ–љ—В—А—Г—О—В—М—Б—П –≤ —А—Ц–Ј–љ–Є—Е —Д—А–∞–Ї—Ж—Ц—П—Е,–Х–ї–µ–Ї—В—А–Њ–Љ—Ц–≥—А–∞—Ж—Ц—П —Ц–Њ–љ—Ц–≤: –њ—А–Є –њ—А–Є–Ї–ї–∞–і–µ–љ–љ—Ц –µ–ї–µ–Ї—В—А–Є—З–љ–Њ–≥–Њ –њ–Њ–ї—П –і–Њ —А–Њ–Ј–њ–ї–∞–≤—Г –∞–±–Њ —А–Њ–Ј—З–Є–љ—Г —Ц–Њ–љ–Є —А—Ц–Ј–љ–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —А—Г—Е–∞—О—В—М—Б—П –Ј —А—Ц–Ј–љ–Њ—О —И–≤–Є–і–Ї—Ц—Б—В—О. –Т –љ–∞–є–Ї—А–∞—Й–Є—Е –Ј —Ж–Є—Е –Љ–µ—В–Њ–і—Ц–≤ –Ї–Њ–µ—Д—Ц—Ж—Ц—Ф–љ—В–Є —А–Њ–Ј–і—Ц–ї–µ–љ–љ—П –љ–µ –њ–µ—А–µ–≤–Є—Й—Г—О—В—М –≤—Ц–і—Б–Њ—В–Ї–∞, —В–Њ–Љ—Г –і–ї—П –µ—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Ј–±–∞–≥–∞—З–µ–љ–љ—П –њ–Њ—В—А—Ц–±–љ–Њ –њ–Њ–≤—В–Њ—А—О–≤–∞—В–Є –њ—А–Њ—Ж–µ—Б —Б–Њ—В–љ—Ц –∞–±–Њ —В–Є—Б—П—З—Ц —А–∞–Ј—Ц–≤.[ 8]
–Ю—Б–Ї—Ц–ї—М–Ї–Є —А—Ц–Ј–љ—Ц —Ц–Ј–Њ—В–Њ–њ–Є –Љ–∞—О—В—М —А—Ц–Ј–љ–Є–є –њ–µ—А—Ц–Њ–і –љ–∞–њ—Ц–≤—А–Њ–Ј–њ–∞–і—Г, —В–Њ, –Ј–љ–∞—О—З–Є –≤–Є—Е—Ц–і–љ—Г –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж—Ц—О —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —Г —А–µ—З–Њ–≤–Є–љ—Ц, –Ј–∞–Љ—Ц—А—П–≤—И–Є —Ч—Ч –њ—Ц–Ј–љ—Ц—И–µ, –Љ–Њ–ґ–љ–∞ –і—Ц–Ј–љ–∞—В–Є—Б—П –≤—Ц–Ї –Ј—А–∞–Ј–Ї–∞. —А–∞–і—Ц–Њ–≤—Г–≥–ї–µ—Ж–µ–≤–Є–є –Љ–µ—В–Њ–і : –≤—Г–≥–ї–µ—Ж—М-14 (—В. –Ј–≤. —А–∞–і—Ц–Њ–≤—Г–≥–ї–µ—Ж—М) –њ–Њ—Б—В—Ц–є–љ–Њ —Г—В–≤–Њ—А—О—Ф—В—М—Б—П –≤ –∞—В–Љ–Њ—Б—Д–µ—А—Ц –њ—Ц–і —З–∞—Б —А–µ–∞–Ї—Ж—Ц—Ч —П–і–µ—А –∞–Ј–Њ—В—Г –Ј –Ї–Њ—Б–Љ—Ц—З–љ–Є–Љ–Є –њ—А–Њ–Љ–µ–љ—П–Љ–Є —Ц —А–Њ–Ј–њ–∞–і–∞—Ф—В—М—Б—П –Ј –њ–µ—А—Ц–Њ–і–Њ–Љ –љ–∞–њ—Ц–≤—А–Њ–Ј–њ–∞–і—Г 5370 —А–Њ–Ї—Ц–≤. –¶—Ц –њ—А–Њ—В–Є–ї–µ–ґ–љ—Ц –њ—А–Њ—Ж–µ—Б–Є –Ї–Њ–Љ–њ–µ–љ—Б—Г—О—В—М –Њ–і–Є–љ –Њ–і–љ–Њ–≥–Њ, —В–Њ–Љ—Г –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж—Ц—П —Ж—М–Њ–≥–Њ —Ц–Ј–Њ—В–Њ–њ—Г –≤ –∞—В–Љ–Њ—Б—Д–µ—А—Ц —Ф –њ–Њ—Б—В—Ц–є–љ–Њ—О, –±–ї–Є–Ј—М–Ї–Њ 1 –∞—В–Њ–Љ—Г 14 –° –љ–∞ 1012 –∞—В–Њ–Љ—Ц–≤ —Б—В–∞–±—Ц–ї—М–љ–Њ–≥–Њ –≤—Г–≥–ї–µ—Ж—О. –Ф–Њ–њ–Њ–Ї–Є –і–µ—П–Ї–Є–є –Њ—А–≥–∞–љ—Ц–Ј–Љ –ґ–Є–≤–µ, –≤—Ц–љ –њ–Њ—Б—В—Ц–є–љ–Њ –Њ–±–Љ—Ц–љ—О—Ф—В—М—Б—П –≤—Г–≥–ї–µ—Ж–µ–Љ –Ј –љ–∞–≤–Ї–Њ–ї–Є—И–љ—Ц–Љ —Б–µ—А–µ–і–Њ–≤–Є—Й–µ–Љ, —В–Њ–Љ—Г —В–∞ —Б–∞–Љ–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж—Ц—П –≤—Б—В–∞–љ–Њ–≤–ї—О—Ф—В—М—Б—П —Ц –≤ –љ—М–Њ–Љ—Г. –Ъ–Њ–ї–Є –Њ—А–≥–∞–љ—Ц–Ј–Љ –њ–Њ–Љ–Є—А–∞—Ф —Ц –њ—А–Њ—Ж–µ—Б–Є –Њ–±–Љ—Ц–љ—Г —А–µ—З–Њ–≤–Є–љ —Г –љ—М–Њ–Љ—Г –њ—А–Є–њ–Є–љ—П—О—В—М—Б—П, –і–Њ–ї—П –≤—Г–≥–ї–µ—Ж—О-14 —Г –љ—М–Њ–Љ—Г –њ–Њ—З–Є–љ–∞—Ф –Ј–Љ–µ–љ—И—Г–≤–∞—В–Є—Б—П. –Ґ–∞–Ї–Є–Љ —З–Є–љ–Њ–Љ, –≤–Є–Љ—Ц—А—П–≤—И–Є –њ–Є—В–Њ–Љ—Г –∞–Ї—В–Є–≤–љ—Ц—Б—В—М 14 –° –≤ –≤—Г–≥–ї–µ—Ж—О, –≤–Є–і—Ц–ї–µ–љ–Њ–Љ—Г –Ј –Ј–∞–ї–Є—И–Ї—Ц–≤ —В–Њ–≥–Њ —З–Є —Ц–љ—И–Њ–≥–Њ –Њ—А–≥–∞–љ—Ц–Ј–Љ—Г, –Љ–Њ–ґ–љ–∞ –і–Њ–≤–Њ–ї—Ц —В–Њ—З–љ–Њ –≤–Є–Ј–љ–∞—З–Є—В–Є, –Ї–Њ–ї–Є —Б–∞–Љ–µ –ґ–Є–≤ —Ж–µ–є –Њ—А–≥–∞–љ—Ц–Ј–Љ. –Ч—А—Г—З–љ—Ц—Б—В—М —Ж—М–Њ–≥–Њ –Љ–µ—В–Њ–і—Г –њ–Њ–ї—П–≥–∞—Ф –≤ —В–Њ–Љ—Г, —Й–Њ –≤—Г–≥–ї–µ—Ж—М –≤—Е–Њ–і–Є—В—М –і–Њ —Б–Ї–ї–∞–і—Г –њ—А–∞–Ї—В–Є—З–љ–Њ –≤—Б—Ц—Е –Њ—А–≥–∞–љ—Ц–Ј–Љ—Ц–≤, —В–Њ–Љ—Г —В–∞–Ї–Є–є –Љ–µ—В–Њ–і —Ф –і–Њ–≤–Њ–ї—Ц —Г–љ—Ц–≤–µ—А—Б–∞–ї—М–љ–Є–Љ. –Ч —Ц–љ—И–Њ–≥–Њ –±–Њ–Ї—Г, —З–µ—А–µ–Ј –≤—Ц–і–љ–Њ—Б–љ–Њ –Ї–Њ—А–Њ—В–Ї–Є–є –њ–µ—А—Ц–Њ–і –љ–∞–њ—Ц–≤—А–Њ–Ј–њ–∞–і—Г, —А–∞–і—Ц–Њ–≤—Г–≥–ї–µ—Ж–µ–≤–Є–є –Љ–µ—В–Њ–і –Љ–Њ–ґ–µ –≤–Є–Ї–Њ—А–Є—Б—В–Њ–≤—Г–≤–∞—В–Є—Б—П –ї–Є—И–µ –і–ї—П –і–∞—В—Г–≤–∞–љ–љ—П –≤—Ц–Ї—Г –Њ—А–≥–∞–љ—Ц–Ј–Љ—Ц–≤, —Й–Њ –љ–µ —Б—В–∞—А—Ц—И—Ц –Ј–∞ 60 000 —А–Њ–Ї—Ц–≤.
–Ф–ї—П –Љ—Ц–љ–µ—А–∞–ї—Ц–≤ –Ј–∞—Б—В–Њ—Б–Њ–≤—Г—О—В—М –Ї–∞–ї—Ц–є-–∞—А–≥–Њ–љ–Њ–≤–Є–є —В–∞ —Г—А–∞–љ-—Б–≤–Є–љ—Ж–µ–≤–Є–є –Љ–µ—В–Њ–і–Є, —Й–Њ –і–Њ–Ј–≤–Њ–ї—П—О—В—М –і–∞—В—Г–≤–∞—В–Є –±—Ц–ї—М—И—Ц —З–∞—Б–Њ–≤—Ц —Ц–љ—В–µ—А–≤–∞–ї–Є.
–І–µ—А–µ–Ј —Е—Ц–Љ—Ц—З–љ—Г –љ–µ—А–Њ–Ј–і—Ц–ї—М–љ—Ц—Б—В—М, —А–∞–і—Ц–Њ–∞–Ї—В–Є–≤–љ—Ц —Ц–Ј–Њ—В–Њ–њ–Є –Љ–Њ–ґ—Г—В—М –≤–Є–Ї–Њ—А–Є—Б—В–Њ–≤—Г–≤–∞—В–Є—Б—П –Њ—А–≥–∞–љ—Ц–Ј–Љ–Њ–Љ (–∞–±–Њ –±—А–∞—В–Є —Г—З–∞—Б—В—М —Г —Е—Ц–Љ—Ц—З–љ–Є—Е —А–µ–∞–Ї—Ж—Ц—П—Е) —В–∞–Ї —Б–∞–Љ–Њ, —П–Ї —Ц –Ј–≤–Є—З–∞–є–љ—Ц. –¶–µ –і–Њ–Ј–≤–Њ–ї—П—Ф –і—Г–ґ–µ —В–Њ—З–љ–Њ —Б–њ–Њ—Б—В–µ—А—Ц–≥–∞—В–Є –Ј–∞ —И–ї—П—Е–∞–Љ–Є –Љ–µ—В–∞–±–Њ–ї—Ц–Ј–Љ—Г —В–Њ–≥–Њ —З–Є —Ц–љ—И–Њ–≥–Њ –µ–ї–µ–Љ–µ–љ—В—Г (–∞–±–Њ —А–µ—З–Њ–≤–Є–љ–Є, –і–µ—П–Ї—Ц –∞—В–Њ–Љ–Є —П–Ї–Њ—Ч –Ј–∞–Љ—Ц–љ–µ–љ—Ц) —Г –Њ—А–≥–∞–љ—Ц–Ј–Љ—Ц. –¶—П –Љ–µ—В–Њ–і–Є–Ї–∞ —Ф —И–Є—А–Њ–Ї–Њ –≤–ґ–Є–≤–∞–љ–Њ—О –≤ –±—Ц–Њ–ї–Њ–≥—Ц—Ч, –Љ–µ–і–Є—Ж–Є–љ—Ц —Ц —В–µ—Е–љ—Ц—Ж—Ц.
–Я—А–Є—А–Њ–і–љ–Є–є –Ї–Є—Б–µ–љ—М –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–є —В—А—М–Њ–Љ–∞ —Б—В–∞–±—Ц–ї—М–љ–Є–Љ–Є —Ц–Ј–Њ—В–Њ–њ–∞–Љ–Є –Ї–Є—Б–µ–љ—М-16, –Ї–Є—Б–µ–љ—М-17 —Ц –Ї–Є—Б–µ–љ—М-18. –Э–µ–Ј–≤–∞–ґ–∞—О—З–Є –љ–∞ —Е—Ц–Љ—Ц—З–љ—Г –њ–Њ–і—Ц–±–љ—Ц—Б—В—М, —Ц–Ј–Њ—В–Њ–њ–Є —В—А–Њ—Е–Є –њ–Њ —А—Ц–Ј–љ–Њ–Љ—Г –±–µ—А—Г—В—М —Г—З–∞—Б—В—М —Г —В–∞–Ї–Є—Е –њ—А–Њ—Ж–µ—Б–∞—Е —П–Ї –≤–Є–њ–∞—А–Њ–≤—Г–≤–∞–љ–љ—П —Ц –Ї–Њ–љ–і–µ–љ—Б–∞—Ж—Ц—П, —В–Њ–Љ—Г –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж—Ц—П –Ї–Є—Б–љ—О-18 —Г –Њ–Ї–µ–∞–љ—Ц –Ј–∞–ї–µ–ґ–Є—В—М –≤—Ц–і –Ї–ї—Ц–Љ–∞—В—Г –њ–ї–∞–љ–µ—В–Є (–∞ —Б–∞–Љ–µ –≤—Ц–і —А–Њ–Ј–Љ—Ц—А—Г –ї—М–Њ–і–Њ–≤–Є–Ї—Ц–≤). –¶–µ–є —Д–∞–Ї—В –≤–Є–Ї–Њ—А–Є—Б—В–Њ–≤—Г—О—В—М –і–ї—П —В–Њ–≥–Њ, —Й–Њ–± –і—Ц–Ј–љ–∞—В–Є—Б—П –Ї–ї—Ц–Љ–∞—В–Є—З–љ—Ц —Г–Љ–Њ–≤–Є –≤ –і–∞–ї–µ–Ї–Њ–Љ—Г –Љ–Є–љ—Г–ї–Њ–Љ—Г вАФ –і–Њ—Б–ї—Ц–і–ґ—Г—О—З–Є –ї—М–Њ–і—П–љ—Ц –Ї–µ—А–љ–Є –Ј –њ–Њ–ї—П—А–љ–Є—Е –ї—М–Њ–і–Њ–≤–Є–Ї—Ц–≤ , –∞–±–Њ –≤–Є–Ј–љ–∞—З–∞—О—З–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж—Ц—О —Ж–Є—Е —Ц–Ј–Њ—В–Њ–њ—Ц–≤ —Г –Љ—Г—И–ї—П—Е —Б–Ї–∞–Љ'—П–љ—Ц–ї–Њ—Б—В–µ–є. [ 9]
–Э–∞ –≤—Ц–і–Љ—Ц–љ—Г –≤—Ц–і —Г—А–∞–љ—Г-238, –≤ —Г—А–∞–љ—Ц-235 –Љ–Њ–ґ–ї–Є–≤–∞ —Б–∞–Љ–Њ–њ—Ц–і—В—А–Є–Љ—Г–≤–∞–љ–∞ –ї–∞–љ—Ж—О–≥–Њ–≤–∞ —А–µ–∞–Ї—Ж—Ц—П. –¶–µ –љ–∞–є–±—Ц–ї—М—И —А–Њ–Ј–њ–Њ–≤—Б—О–і–ґ–µ–љ–Є–є —Г –њ—А–Є—А–Њ–і—Ц —Ц–Ј–Њ—В–Њ–њ, —Й–Њ –Љ–∞—Ф —В–∞–Ї—Ц –≤–ї–∞—Б—В–Є–≤–Њ—Б—В—Ц, —З–µ—А–µ–Ј —Й–Њ —Б–∞–Љ–µ –≤—Ц–љ –≤–Є–Ї–Њ—А–Є—Б—В–Њ–≤—Г—Ф—В—М—Б—П –њ—А–Є –≤–Є—А–Њ–±–љ–Є—Ж—В–≤—Ц —П–і–µ—А–љ–Њ—Ч –Ј–±—А–Њ—Ч, –∞ —В–∞–Ї–Њ–ґ –≤ –∞—В–Њ–Љ–љ–Є—Е —А–µ–∞–Ї—В–Њ—А–∞—Е. –Я—А–Є —Ж—М–Њ–Љ—Г –є–Њ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж—Ц—П –≤ –њ—А–Є—А–Њ–і–љ–Њ–Љ—Г —Г—А–∞–љ—Ц —Б—В–∞–љ–Њ–≤–Є—В—М –ї–Є—И–µ 0,72%, —В–Њ–Љ—Г –і—Г–ґ–µ –≤–∞–ґ–ї–Є–≤–Є–Љ —Ф –њ–Є—В–∞–љ–љ—П —А–Њ–Ј–і—Ц–ї–µ–љ–љ—П —Ц–Ј–Њ—В–Њ–њ—Ц–≤.
–£ –Љ–µ–і–Є—Ж–Є–љ—Ц, –љ–∞ –≤–Є–Ї–Њ—А–Є—Б—В–∞–љ–љ—Ц —П–≤–Є—Й–∞ —П–і–µ—А–љ–Њ–≥–Њ –Љ–∞–≥–љ—Ц—В–љ–Њ–≥–Њ —А–µ–Ј–Њ–љ–∞–љ—Б—Г –њ–Њ–±—Г–і–Њ–≤–∞–љ—Ц –Ї—Ц–ї—М–Ї–∞ –≤–∞–ґ–ї–Є–≤–Є—Е –і—Ц–∞–≥–љ–Њ—Б—В–Є—З–љ–Є—Е —В–µ—Е–љ—Ц–Ї, —В–∞–Ї–Є—Е —П–Ї –ѓ–Ь–†-—Б–њ–µ–Ї—В—А–Њ—Б–Ї–Њ–њ—Ц—П —Ц –Љ–∞–≥–љ—Ц—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ–∞ —В–Њ–Љ–Њ–≥—А–∞—Д—Ц—П . –Я—А–Њ—В–µ, —П–і–µ—А–љ–Є–є –Љ–∞–≥–љ—Ц—В–љ–Є–є —А–µ–Ј–Њ–љ–∞–љ—Б –≤–Є–љ–Є–Ї–∞—Ф –Ј–∞ —А–∞—Е—Г–љ–Њ–Ї –Љ–∞–≥–љ—Ц—В–љ–Є—Е –≤–ї–∞—Б—В–Є–≤–Њ—Б—В–µ–є —П–і—А–∞, –∞ —В–Њ–Љ—Г —В–∞–Ї—Ц –Љ–µ—В–Њ–і–Є–Ї–Є –њ—А–∞—Ж—О—О—В—М –ї–Є—И–µ –і–ї—П —П–і–µ—А, —Й–Њ –Љ–∞—О—В—М –љ–µ—Ж—Ц–ї–Є–є —Б–њ—Ц–љ. –Ґ–∞–Ї–Є–Љ —З–Є–љ–Њ–Љ, –ї–Є—И–µ —Ц–Ј–Њ—В–Њ–њ–Є –Ј –љ–µ–њ–∞—А–љ–Є–Љ —З–Є—Б–ї–Њ–Љ –љ—Г–Ї–ї–Њ–љ—Ц–≤ –Љ–Њ–ґ—Г—В—М –≤–Є–Ї–Њ—А–Є—Б—В–Њ–≤—Г–≤–∞—В–Є—Б—П –і–ї—П —Ж—М–Њ–≥–Њ.[ 10]