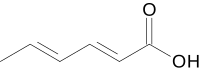
Ácido sórbico
| |||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

Pedro ArmendárizLahirPedro Gregorio Armendáriz HastingsTahun aktif1935–1963Tinggi6' 1 (1.85 m)Suami/istriCarmelita Bohr (1917-1963) Pedro Armendáriz (9 Mei 1912 – 18 Juni 1963) adalah seorang aktor berkebangsaan Meksiko. Dia berkarier di dunia film sejak tahun 1935 hingga 1963. Pedro Armendáriz meninggal dunia pada tanggal 18 Juni 1963 karena bunuh diri. Filmografi Hollywood Tahun Film Peran Catatan 1947 The Fugitive Letnan di polisi aka El Fugitivo (Meksiko) 1948 ...

Bar koktail yang ramai Efek pesta koktail adalah fenomena di mana otak memfokuskan perhatian seseorang pada stimulus tertentu, biasanya pendengaran. Fokus ini mengecualikan serangkaian rangsangan lain dari kesadaran, seperti ketika pengunjung pesta mengikuti satu percakapan di ruangan yang bising.[1][2] Kemampuan ini tersebar luas di kalangan manusia, dengan sebagian besar pendengar dapat dengan mudah membagi totalitas suara yang terdeteksi oleh telinga ke dalam aliran-aliran ...

Turkish politician Ahmet Fetgeri AşeniPersonal detailsBorn1886Sakarya Province, Ottoman EmpireDied1966Kocaeli, TurkeyNationalityTurkish Ahmet Fetgeri Aşeni (1886–1966) was a Turkish navy officer, sports official and politician during the Atatürk era. He was also one of the founding members of Beşiktaş JK, which he also served as a president.[1][2] Life He served as the president of the Turkish Wrestling Federation and the Turkish Athletics Federation. He graduated from ...

Pemberontakan MandorTugu Mandor di PontianakTanggal23 Oktober 1884 - 5 Februari 1885LokasiKalimantanHasil Belanda menang. Republik Lanfang dianeksasi oleh Hindia Belanda. Pihak terlibat Belanda Republik LanfangMilisi Dayak dan Tionghoa Indonesia Didukung oleh: Dinasti QingTokoh dan pemimpin A.J. Tengbergen L.T.H. Cranen Erik S. ShoreFredrik van Braam Morris Lin Ah Sin Xelen Chi Tong (WIA) Zhou Wu Li Peng Shilun (POW)Kekuatan 4.000 10.000Korban T...

American lawyer and politician (1932–2022) James V. StantonMember of the U.S. House of Representativesfrom Ohio's 20th districtIn officeJanuary 3, 1971 – January 3, 1977Preceded byMichael A. FeighanSucceeded byMary Rose OakarPresident of the Cleveland City CouncilIn office1964–1970Preceded byJack P. RussellSucceeded byAnthony GarofoliMember of the Cleveland City CouncilIn office1959–1970 Personal detailsBornJames Vincent Stanton(1932-02-27)February 27, 1932Clevela...

Durante la seconda guerra mondiale i bambini sia maschi che femmine, furono frequentemente protagonisti di eventi insurrezionali, nonché arruolati (volontariamente, coercitivamente o perché mentivano sulla propria età) da parte sia delle potenze dell'Asse e dagli Alleati, che da altri stati belligeranti e da gruppi ebraici. Erano dediti a servizi di vario tipo sia in luoghi non oggetto di combattimento diretto che nelle retrovie, fino ad essere impiegati in azioni belliche. La tutela dell�...

Синелобый амазон Научная классификация Домен:ЭукариотыЦарство:ЖивотныеПодцарство:ЭуметазоиБез ранга:Двусторонне-симметричныеБез ранга:ВторичноротыеТип:ХордовыеПодтип:ПозвоночныеИнфратип:ЧелюстноротыеНадкласс:ЧетвероногиеКлада:АмниотыКлада:ЗавропсидыКласс:Пт�...

مارية تشارلز (بالإنجليزية: Maria Charles) معلومات شخصية اسم الولادة (بالإنجليزية: Maria Zena Schneider) الميلاد 22 سبتمبر 1929 لندن تاريخ الوفاة 21 أبريل 2023 (93 سنة) [1] مواطنة المملكة المتحدة الزوج روبن هنتر (1952–1966) الأولاد كيلي هنتر عدد الأولاد 2 الحياة الع�...

Artikel ini sebatang kara, artinya tidak ada artikel lain yang memiliki pranala balik ke halaman ini.Bantulah menambah pranala ke artikel ini dari artikel yang berhubungan atau coba peralatan pencari pranala.Tag ini diberikan pada Oktober 2023. Artikel ini memiliki beberapa masalah. Tolong bantu memperbaikinya atau diskusikan masalah-masalah ini di halaman pembicaraannya. (Pelajari bagaimana dan kapan saat yang tepat untuk menghapus templat pesan ini) Artikel atau bagian mungkin perlu ditulis...

Human settlement in EnglandUbbestonUbbestonLocation within SuffolkDistrictEast SuffolkShire countySuffolkRegionEastCountryEnglandSovereign stateUnited KingdomPost townHalesworthPostcode districtIP19UK ParliamentSuffolk Coastal List of places UK England Suffolk 52°18′07″N 1°24′25″E / 52.302017°N 1.406973°E / 52.302017; 1.406973 Ubbeston is a village and civil parish in the East Suffolk district, in the county of Suffolk, England. It is l...

† Египтопитек Реконструкция внешнего вида египтопитека Научная классификация Домен:ЭукариотыЦарство:ЖивотныеПодцарство:ЭуметазоиБез ранга:Двусторонне-симметричныеБез ранга:ВторичноротыеТип:ХордовыеПодтип:ПозвоночныеИнфратип:ЧелюстноротыеНадкласс:Четвероно...

この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。出典を追加して記事の信頼性向上にご協力ください。(このテンプレートの使い方)出典検索?: コルク – ニュース · 書籍 · スカラー · CiNii · J-STAGE · NDL · dlib.jp · ジャパンサーチ · TWL(2017年4月) コルクを打ち抜いて作った瓶の栓 コルク(木栓、�...

这是马来族人名,“尤索夫”是父名,不是姓氏,提及此人时应以其自身的名“法迪拉”为主。 尊敬的拿督斯里哈芝法迪拉·尤索夫Fadillah bin Haji YusofSSAP DGSM PGBK 国会议员 副首相 第14任马来西亚副首相现任就任日期2022年12月3日与阿末扎希同时在任君主最高元首苏丹阿都拉陛下最高元首苏丹依布拉欣·依斯迈陛下首相安华·依布拉欣前任依斯迈沙比里 马来西亚能源转型与�...

Artikel ini sebatang kara, artinya tidak ada artikel lain yang memiliki pranala balik ke halaman ini.Bantulah menambah pranala ke artikel ini dari artikel yang berhubungan atau coba peralatan pencari pranala.Tag ini diberikan pada Desember 2022. Muhammad Syafiuddin II Muhammad Syafiuddin II (18 November 1841 – 12 September 1924) adalah seorang sultan Sambas. Pada 1891, ia dianugerahi Bahaderi Singa Nederland (Rider in de orde van den Nederlansche Indie Leeuw) oleh Raja William...

2024 Total Nonstop Action Wrestling event SacrificePromotional poster featuring Jody Threat, Eric Young, Chris Sabin, Ace Austin, and Chris BeyPromotionTotal Nonstop Action WrestlingDateMarch 8, 2024CityWindsor, Ontario, CanadaVenueSt. Clair CollegeTNA+ Monthly Specials chronology ← PreviousNo Surrender Next →Under Siege Sacrifice chronology ← Previous2023 Next →— The 2024 Sacrifice was a professional wrestling event produced by Total Nonstop Action Wrestling...

187th Airlift Squadron187th Airlift Squadron C-130H 92-1531 Modular Airborne Fire Fighting Systems (MAFFS) aerial fire fighting aircraftActive1943–presentCountry United StatesAllegiance WyomingBranch Air National GuardTypeSquadronRoleAirlift/Aerial FirefightingPart ofWyoming Air National GuardGarrison/HQCheyenne Air National Guard Base, Cheyenne, WyomingTail CodeYellow tail stripe WyomingInsignia187th Airlift SquadronMilitary unit The 187th Airlift Squadron (187 AS) is...

Fourth running of the Indianapolis 500 4th Indianapolis 500Indianapolis Motor SpeedwayIndianapolis 500Sanctioning bodyAAADateMay 30, 1914WinnerRené ThomasWinning EntrantDelageAverage speed82.474 mph (132.729 km/h)Pole positionJean ChassagnePole speedGrid set by blind drawMost laps ledRené Thomas (102)Pre-racePace carStoddard-DaytonPace car driverCarl G. FisherStarterThomas J. Hay[1]Honorary refereeJohn A. Wilson[1]Estimated attendance110,000[2]Chronology Pr...

Hellenic Army general Konstantinos SapountzakisKonstantinos Sapountzakis at Filippiada c. 1913Native nameΚωνσταντίνος ΣαπουντζάκηςBornc. 1846Rethymno, Crete, Ottoman Empire (now Greece)Diedc. 1931 (aged 84–85)Athens, Second Hellenic RepublicAllegiance Kingdom of GreeceService/branch Hellenic ArmyYears of service1865–1913Rank Lieutenant GeneralCommands heldArmy General CommandArmy of Epirus6th Infantry Division8th Infantry DivisionBattles/wars Cre...

Canyon on the Colorado River where Hoover Dam was built This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Black Canyon of the Colorado – news · newspapers · books · scholar · JSTOR (June 2007) (Learn how and when to remove this message) Black CanyonBlack Canyon, photographed in 1871Black Canyon of the Colorado...

American baseball player (born 1973) Baseball player Bob HowryHowry with the Chicago Cubs in 2007PitcherBorn: (1973-08-04) August 4, 1973 (age 50)Phoenix, Arizona, U.S.Batted: LeftThrew: RightMLB debutJune 21, 1998, for the Chicago White SoxLast MLB appearanceJuly 28, 2010, for the Chicago CubsMLB statisticsWin–loss record45–52Earned run average3.84Strikeouts653 Teams Chicago White Sox (1998–2002) Boston Red Sox (2002–2003) Cleveland Indians (2004–...