ฮ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮฎ ฮผฯ
ฯฮผฮทฮบฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮฎ ฯฮฟฯฮผฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮตฮฏฮฝฮฑฮน ฮฟฯฮณฮฑฮฝฮนฮบฮฎ ฯฮทฮผฮนฮบฮฎ ฮญฮฝฯฯฮท, ฮผฮต ฮผฮฟฯฮนฮฑฮบฯ ฯฯฯฮฟ C2H4O2, ฮฑฮฝ ฮบฮฑฮน ฯฯฮทฯฮนฮผฮฟฯฮฟฮนฮฟฯฮฝฯฮฑฮน ฯฮตฯฮนฯฯฯฯฮตฯฮฟ ฮฟฮน ฯฮนฮฟ ฮฑฮฝฮฑฮปฯ
ฯฮนฮบฮฟฮฏ (ฮทฮผฮนฯฯ
ฮฝฯฮฑฮบฯฮนฮบฮฟฮฏ) ฯฯฯฮฟฮน: HCO2CH3, HCOOCH3 ฮบฮฑฮน HCO2Me. ฮฮต ฮฒฮฌฯฮท ฯฮฟ ฯฯฯฯฮทฮผฮฑ ฮบฯฮดฮนฮบฮฎฯ ฮฟฮฝฮฟฮผฮฑฯฮฏฮฑฯ ฯฮฟฯ
ฮพฮตฮบฮฏฮฝฮทฯฮต ฮผฮต ฯฮฟฯ
ฯ ฯฮธฮฟฯฮฟฯฮปฯฯฮฌฮฝฮธฯฮฑฮบฮตฯ, ฮญฯฮตฮน ฯฮฟฮฝ ฮบฯฮดฮนฮบฯ R-611, ฯฯ ฯฯ
ฮบฯฮนฮบฯ ฮผฮญฯฮฟ. ฮฮฏฮฝฮฑฮน ฮฟ ฮฑฯฮปฮฟฯฯฯฮตฯฮฟฯ ฮบฮฑฯฮฒฮฟฮพฯ
ฮปฮนฮบฯฯ ฮตฯฯฮญฯฮฑฯ, ฮบฮฑฮน ฯฮนฮฟ ฯฯ
ฮณฮบฮตฮบฯฮนฮผฮญฮฝฮฑ, ฮฟ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฯฮฟฯ
ฮผฮตฮธฮฑฮฝฮนฮบฮฟฯ ฮฟฮพฮญฮฟฯ. ฮ ฯฮทฮผฮนฮบฮฌ ฮบฮฑฮธฮฑฯฯฯ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ, ฯฯฮนฯ ฮบฮฑฮฝฮฟฮฝฮนฮบฮญฯ ฯฯ
ฮฝฮธฮฎฮบฮตฯ ฯฮตฯฮนฮฒฮฌฮปฮปฮฟฮฝฯฮฟฯ, ฮดฮทฮปฮฑฮดฮฎ ฯฮต ฮธฮตฯฮผฮฟฮบฯฮฑฯฮฏฮฑ 25ยฐC ฯ
ฯฯ ฯฮฏฮตฯฮท 1 atm, ฮตฮฏฮฝฮฑฮน ฮดฮนฮฑฯ
ฮณฮญฯ ฯ
ฮณฯฯ, ฮผฮต ฮฑฮนฮธฮญฯฮนฮฑ ฮตฯ
ฯฮฌฯฮนฯฯฮท ฮฟฯฮผฮฎ, ฯฮฟฯ
ฯฮต ฮผฮตฯฮนฮบฮฟฯฯ ฮฑฮฝฮธฯฯฯฮฟฯ
ฯ ฮธฯ
ฮผฮฏฮถฮตฮน ฮปฮตฮผฯฮฝฮน ฮฎ ฮปฮตฮผฮฟฮฝฮฌฮดฮฑ[2], ฯ
ฯฮทฮปฮฎ ฯฮฌฯฮท ฮฑฯฮผฯฮฝ ฮบฮฑฮน ฯฮฑฮผฮทฮปฮฎ ฮตฯฮนฯฮฑฮฝฮตฮนฮฑฮบฮฎ ฯฮฌฯฮท. ฮฯฮฟฯฮตฮปฮตฮฏ ฯฯฯฮดฯฮฟฮผฮท ฮญฮฝฯฯฮท ฮณฮนฮฑ ฯฮฟฮปฮปฮญฯ ฮฌฮปฮปฮตฯ ฯฮทฮผฮนฮบฮญฯ ฮตฮฝฯฯฮตฮนฯ, ฮบฮฌฯฮฟฮนฮตฯ ฮฑฯฯ ฯฮนฯ ฮฟฯฮฟฮฏฮตฯ ฮญฯฮฟฯ
ฮฝ ฮตฮผฯฮฟฯฮนฮบฯ ฮตฮฝฮดฮนฮฑฯฮญฯฮฟฮฝ.[3]
ฮฯฮฟฮผฮญฯฮตฮนฮฑ
ฮฮต ฮฒฮฌฯฮท ฯฮฟ ฮผฮฟฯฮนฮฑฮบฯ ฯฯฯฮฟ ฯฮฟฯ
, C2H4O2, ฮฟ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮตฮฏฮฝฮฑฮน ฮญฮฝฮฑฯ ฮฑฯฯ ฯฮฟฯ
ฯ ยซฯฯ
ฯฮนฮบฮฟฯฯยป ฯ
ฮดฮฑฯฮฌฮฝฮธฯฮฌฮบฮตฯ (ฮดฮทฮปฮฑฮดฮฎ ฯฮนฯ ฮตฮฝฯฯฮตฮนฯ ฯฮฟฯ
ฮญฯฮฟฯ
ฮฝ ฯฮทฮฝ ฮฑฮฝฮฑฮปฮฟฮณฮฏฮฑ ฮฑฯฯฮผฯฮฝ ฯ
ฮดฯฮฟฮณฯฮฝฮฟฯ
- ฮฟฮพฯ
ฮณฯฮฝฮฟฯ
2:1, ฯฮฟฯ
ฮญฯฮตฮน ฮบฮฑฮน ฯฮฟ ฮฝฮตฯฯ, ฮฑฮปฮปฮฌ ฯฯฯฮฏฯ ฮฝฮฑ ฮตฮฏฮฝฮฑฮน ฯฯฮฑฮณฮผฮฑฯฮนฮบฮฌ ฯฮฌฮบฯฮฑฯฮฑ). ฮฮบฯฮผฮท, ฮผฮต ฮฒฮฌฯฮท ฯฮฟฮฝ ฮฏฮดฮนฮฟ ฯฯฯฮฟ, ฮฟ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮญฯฮตฮน ฯฮฑ ฮฑฮบฯฮปฮฟฯ
ฮธฮฑ ฮตฮฝฮฝฮญฮฑ (9) ฮนฯฮฟฮผฮตฯฮฎ ฮธฮญฯฮทฯ:
- ฮฮนฮฝฯ
ฮปฯ
ฮดฯฮฟฯฯฮตฯฮฟฮพฮตฮฏฮดฮนฮฟ ฮผฮต ฮทฮผฮนฯฯ
ฮฝฯฮฑฮบฯฮนฮบฯ ฯฯฯฮฟ CH2=CHO2H.
- 1,1-ฮฑฮนฮธฮตฮฝฮฟฮดฮนฯฮปฮท ฮผฮต ฮทฮผฮนฯฯ
ฮฝฯฮฑฮบฯฮนฮบฯ ฯฯฯฮฟ CH2=C(OH)2.
- 1,2-ฮฑฮนฮธฮตฮฝฮฟฮดฮนฯฮปฮท ฮผฮต ฮทฮผฮนฯฯ
ฮฝฯฮฑฮบฯฮนฮบฯ ฯฯฯฮฟ HOCH=CHOH [ฯฮต ฮดฯฮฟ (2) ฮณฮตฯฮผฮตฯฯฮนฮบฮฌ ฮนฯฮฟฮผฮตฯฮฎ].
- ฮฅฮดฯฮฟฮพฯ
ฮฑฮนฮธฮฑฮฝฮฌฮปฮท ฮผฮต ฮทฮผฮนฯฯ
ฮฝฯฮฑฮบฯฮนฮบฯ ฯฯฯฮฟ HOCH2CHO.
- ฮฮนฮธฮฑฮฝฮนฮบฯ ฮฟฮพฯ ฮผฮต ฮทฮผฮนฯฯ
ฮฝฯฮฑฮบฯฮนฮบฯ ฯฯฯฮฟ CH3COOH ฮฎ CH3CO2H.
- 1,2-ฮดฮนฮฟฮพฮตฯฮฌฮฝฮนฮฟ ฮผฮต ฮณฯฮฑฮผฮผฮนฮบฯ ฯฯฯฮฟ

- 1,3-ฮดฮนฮฟฮพฮตฯฮฌฮฝฮนฮฟ ฮผฮต ฮณฯฮฑฮผฮผฮนฮบฯ ฯฯฯฮฟ

- ฮฮตฮธฯ
ฮปฮฟฮดฮนฮฟฮพฮนฯฮฌฮฝฮนฮฟ ฮผฮต ฮณฯฮฑฮผฮผฮนฮบฯ ฯฯฯฮฟ
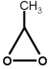
- ฮฮพฮนฯฮฑฮฝฯฮปฮท ฮผฮต ฮณฯฮฑฮผฮผฮนฮบฯ ฯฯฯฮฟ

ฮฮฟฮผฮฎ
| ฮฮตฯฮผฮฟฮฏ[4]
|
| ฮฮตฯฮผฯฯ |
ฯฯฯฮฟฯ ฮดฮตฯฮผฮฟฯ |
ฮทฮปฮตฮบฯฯฮฟฮฝฮนฮบฮฎ ฮดฮฟฮผฮฎ |
ฮฮฎฮบฮฟฯ ฮดฮตฯฮผฮฟฯ |
ฮฮฟฮฝฮนฯฮผฯฯ
|
| C#1'-H |
ฯ |
2sp3-1s |
109 pm |
3% C- H+
|
| C#1-H |
ฯ |
2sp2-1s |
106 pm |
3% C- H+
|
| C=O |
ฯ |
2sp2-2sp2 |
132 pm |
19% C+ O-
|
|
ฯ |
2p-2p |
|
|
| C#1-O |
ฯ |
2sp2-2sp3 |
147 pm |
19% C+ O-
|
| C#1'-O |
ฯ |
2sp3-2sp3 |
150 pm |
19% C+ O-
|
| ฮฯฮฝฮฏฮตฯ
|
| HC#1'H |
109ยฐ28'
|
| HC#1'O |
109ยฐ28'
|
| HC#1O |
120ยฐ
|
| C#1OO |
120ยฐ
|
| OC#1O |
120ยฐ
|
| COC |
104,45ยฐ
|
| ฮฃฯฮฑฯฮนฯฯฮนฮบฯ ฮทฮปฮตฮบฯฯฮนฮบฯ ฯฮฟฯฯฮฏฮฟ[5]
|
| ฮ (-O-) |
-0,38
|
| ฮ (=O) |
-0,38
|
| ฮ (HC) |
+0,03
|
| C#1' |
+0,10
|
| C#1 |
+0,54
|
ฮ ฮฑฯฮฑฮณฯฮณฮฎ
ฮฮนฮฟฮผฮทฯฮฑฮฝฮนฮบฮฎ ฮผฮญฮธฮฟฮดฮฟฯ
ฮ ฮฒฮนฮฟฮผฮทฯฮฑฮฝฮฏฮฑ ฯฯ
ฮฝฮฎฮธฯฯ ฯฯฮฟฯฮนฮผฮฌ ฯฮทฮฝ ฮฑฮฝฯฮฏฮดฯฮฑฯฮท ฮผฮตฮธฮฑฮฝฯฮปฮทฯ (CH3OH) ฮบฮฑฮน ฮผฮฟฮฝฮฟฮพฮตฮนฮดฮฏฮฟฯ
ฯฮฟฯ
ฮฌฮฝฮธฯฮฑฮบฮฑ (CO), ฯฮฑฯฮฟฯ
ฯฮฏฮฑ ฮผฮนฮฑฯ ฮนฯฯฯ
ฯฮฎฯ ฮฒฮฌฯฮทฯ, ฯฯ
ฮฝฮฎฮธฯฯ ฯฮฟฯ
ฮผฮตฮธฮฑฮฝฮฟฮปฮนฮบฮฟฯ ฮฝฮฑฯฯฮฏฮฟฯ
(CH3ONa)[6]:

ฮ ฮผฮญฮธฮฟฮดฮฟฯ ฮฑฯ
ฯฮฎ ฮดฮฏฮฝฮตฮน ฮบฮฑฮปฯฯฮตฯฮฑ ฮฑฯฮฟฯฮตฮปฮญฯฮผฮฑฯฮฑ ฯฯฮฑฮฝ ฯฯฮทฯฮนฮผฮฟฯฮฟฮนฮฟฯฮฝฯฮฑฮน ฯฯฮฟ ฯฮฟ ฮดฯ
ฮฝฮฑฯฯ ฯฮนฮฟ ฮพฮทฯฮฌ ฮฑฮฝฯฮนฮดฯฮฑฯฯฮฎฯฮนฮฑ, ฮณฮนฮฑฯฮฏ ฮฟ ฮบฮฑฯฮฑฮปฯฯฮทฯ ฯฮทฯ ฮตฮฏฮฝฮฑฮน ฮตฯ
ฮฑฮฏฯฮธฮทฯฮฟฯ ฯฯฮทฮฝ ฯฮฑฯฮฟฯ
ฯฮฏฮฑ ฮฝฮตฯฮฟฯ (H2O)[7].
ฮฯฮณฮฑฯฯฮทฯฮนฮฑฮบฮญฯ ฮผฮญฮธฮฟฮดฮฟฮน
ฮฯฯฮตฯฮฟฯฮฟฮฏฮทฯฮท
ฮ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮผฯฮฟฯฮตฮฏ ฮฝฮฑ ฯฮฑฯฮฑฯฮธฮตฮฏ ฮผฮต ฮฑฮฝฯฮฏฮดฯฮฑฯฮท ฮตฯฯฮตฯฮฟฯฮฟฮฏฮทฯฮทฯ ฮผฮตฮธฮฑฮฝฯฮปฮทฯ (CH3OH) ฮบฮฑฮน ฮผฮตฮธฮฑฮฝฮนฮบฮฟฯ ฮฟฮพฮญฮฟฯ (HCOOH) ฯฮต ฯฮพฮนฮฝฮฟ ฯฮตฯฮนฮฒฮฌฮปฮปฮฟฮฝ[8][9]:

ฮฮปฮบฯ
ฮปฮฏฯฯฮท
ฮ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮผฯฮฟฯฮตฮฏ ฮฝฮฑ ฯฮฑฯฮฑฯฮธฮตฮฏ ฮผฮต ฮฑฮฝฯฮฏฮดฯฮฑฯฮท ฮฑฮปฮบฯ
ฮปฮฏฯฯฮทฯ ฮผฮตฮธฮฑฮฝฮนฮบฮฟฯ ฮฝฮฑฯฯฮฏฮฟฯ
(HCOONa) ฮผฮต ฮผฮตฮธฯ
ฮปฮฑฮปฮฟฮณฮฟฮฝฮฏฮดฮนฮฟ (CH3X)[10]:

ฮฮบฯ
ฮปฮฏฯฯฮท
ฮ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮผฯฮฟฯฮตฮฏ ฮฝฮฑ ฯฮฑฯฮฑฯฮธฮตฮฏ ฮผฮต ฮฑฮฝฯฮฏฮดฯฮฑฯฮท ฮฑฮบฯ
ฮปฮฏฯฯฮทฯ ฮผฮตฮธฮฑฮฝฯฮปฮทฯ (CH3OH), ฮผฮต ฯฮนฯ ฮฑฮบฯฮปฮฟฯ
ฮธฮตฯ ฯฮทฮผฮนฮบฮญฯ ฮตฮฝฯฯฮตฮนฯ[11]:
1. ฮฮต ฯฮฟฯฮผฯ
ฮปฮฑฮปฮฟฮณฮฟฮฝฮฏฮดฮนฮฟ (HCOX):

2. ฮฮต ฮฑฮฝฮธฯฮฑฮบฮนฮบฯ ฮฟฮพฯ (H2CO3):

3. ฮฮต ฮฌฮปฮปฮฟฮฝ ฮผฮตฮธฮฑฮฝฮนฮบฯ ฮฑฮปฮบฯ
ฮปฮตฯฯฮญฯฮฑ (ฮผฮตฯฮตฯฯฮตฯฮฟฯฮฟฮฏฮทฯฮท, HCOOR):

ฮงฮทฮผฮนฮบฮญฯ ฮนฮดฮนฯฯฮทฯฮตฯ
ฮฃฮฑฯฯฮฝฮฟฯฮฟฮฏฮทฯฮท
ฮ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮดฮฏฮฝฮตฮน ฮฑฮฝฯฮฏฮดฯฮฑฯฮท ฯฮฑฯฯฮฝฮฟฯฮฟฮฏฮทฯฮทฯ ฮผฮต ฯ
ฮดฯฮฟฮพฮตฮฏฮดฮนฮฟ ฯฮฟฯ
ฮฝฮฑฯฯฮฏฮฟฯ
(NaOH), ฯฯฮทฮผฮฑฯฮฏฮถฮฟฮฝฯฮฑฯ ฮผฮตฮธฮฑฮฝฮนฮบฯ ฮฝฮฌฯฯฮนฮฟ (HCOONa) ฮบฮฑฮน ฮผฮตฮธฮฑฮฝฯฮปฮท (CH3OH)[12]:

ฮฮตฯฮตฯฯฮตฯฮฟฯฮฟฮฏฮทฯฮท
ฮ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮดฮฏฮฝฮตฮน ฮฑฮฝฯฮฏฮดฯฮฑฯฮท ฮผฮตฯฮตฯฯฮตฯฮฟฯฮฟฮฏฮทฯฮทฯ ฮผฮต ฮฑฮปฮบฮฟฯฮปฮท (ROH), ฯฯฮทฮผฮฑฯฮฏฮถฮฟฮฝฯฮฑฯ ฮผฮตฮธฮฑฮฝฮนฮบฯ ฮฑฮปฮบฯ
ฮปฮตฯฯฮญฯฮฑ ฮบฮฑฮน ฮผฮตฮธฮฑฮฝฯฮปฮท[13]:

ฮฮผฮผฯฮฝฮนฯฮปฯ
ฯฮท
ฮ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮดฮฏฮฝฮตฮน ฮฑฮฝฯฮฏฮดฯฮฑฯฮท ฮฑฮผฮผฯฮฝฮนฯฮปฯ
ฯฮทฯ ฮผฮต ฮฑฮผฮผฯฮฝฮฏฮฑ (NH3), ฯฯฮทฮผฮฑฯฮฏฮถฮฟฮฝฯฮฑฯ ฮผฮตฮธฮฑฮฝฮฑฮผฮฏฮดฮนฮฟ (HCONH2) ฮบฮฑฮน ฮผฮตฮธฮฑฮฝฯฮปฮท (CH3OH)[14]:

ฮฮผฮนฮฝฯฮปฯ
ฯฮท
ฮ ฯฯฮบฮตฮนฯฮฑฮน ฮณฮนฮฑ ฮผฮนฮฑ ฯฮฑฯฮฑฮปฮปฮฑฮณฮฎ ฯฮทฯ ฮฑฮผฮผฯฮฝฮนฯฮปฯ
ฯฮทฯ, ฮบฮฑฯฮฌ ฯฮทฮฝ ฮฟฯฮฟฮฏฮฑ ฯฯฮทฯฮนฮผฮฟฯฮฟฮนฮตฮฏฯฮฑฮน ฯฯฯฯฮฟฯฮฑฮณฮฎฯ ฮฎ ฮดฮตฯ
ฯฮตฯฮฟฯฮฑฮณฮฎฯ ฮฑฮผฮฏฮฝฮท (RNH2 ฮฎ R2NH, ฮผฮต ฯฯฮน ฯ
ฯฮฟฯฯฮตฯฯฮนฮบฮฌ ฮฏฮดฮนฮฑ ฯฮฑ R), ฮฑฮฝฯฮฏ ฮฑฮผฮผฯฮฝฮฏฮฑฯ, ฯฯฮทฮผฮฑฯฮฏฮถฮฟฮฝฯฮฑฯ N-ฮฑฮปฮบฯ
ฮปฮฟฮผฮตฮธฮฑฮฝฮฑฮผฮฏฮดฮนฮฟ (HCONHR) ฮฎ N,N-ฮดฮนฮฑฮปฮบฯ
ฮปฮฟฮผฮตฮธฮฑฮฝฮฑฮผฮฏฮดฮนฮฟ (HCONR2), ฮฑฮฝฯฮนฯฯฮฟฮฏฯฯฯ, ฮฑฮฝฯฮฏ ฮผฮตฮธฮฑฮฝฮฑฮผฮนฮดฮฏฮฟฯ
:[14]


ฮฯฮฏฮดฯฮฑฯฮท ฮฟฯฮณฮฑฮฝฮฟฮผฮฑฮณฮฝฮทฯฮนฮฑฮบฯฮฝ ฮตฮฝฯฯฮตฯฮฝ
ฮ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮดฮฏฮฝฮตฮน ฮฑฮฝฯฮฏฮดฯฮฑฯฮท ฮตฯฮฏฮดฯฮฑฯฮทฯ ฮฟฯฮณฮฑฮฝฮฟฮผฮฑฮณฮฝฮทฯฮนฮฑฮบฯฮฝ ฮตฮฝฯฯฮตฯฮฝ (RMgX), ฯฯฮทฮผฮฑฯฮฏฮถฮฟฮฝฯฮฑฯ ฮฑฮปฮดฮตฮฐฮดฮท (RCHO) ฮบฮฑฮน ฮผฮตฮธฯ
ฮปฮฟฮผฮฑฮณฮฝฮทฯฮนฮฟฮฑฮปฮฟฮณฮฟฮฝฮฏฮดฮนฮฟ (CH3OMgX)[15][16]:

ฮฮฝฮฑฮณฯฮณฮฎ
ฮ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮดฮฏฮฝฮตฮน ฮฑฮฝฯฮนฮดฯฮฌฯฮตฮนฯ ฮฟฮพฮตฮนฮดฮฟฮฑฮฝฮฑฮณฯฮณฮฎฯ, ฯฯฮทฮผฮฑฯฮฏฮถฮฟฮฝฯฮฑฯ ฮผฮตฮธฮฑฮฝฯฮปฮท (CH3OH)[17]:
1. ฮฮต ฮฝฮฌฯฯฮนฮฟ (Na) ฮบฮฑฮน ฮฑฮนฮธฮฑฮฝฯฮปฮท (CH3CH2OH):

2. ฮฮต ฮดฮนฯ
ฮดฯฮฟฮณฯฮฝฮฟ (H2) ฮบฮฑฮน ฮฝฮนฮบฮญฮปฮนฮฟ (Ni):

3. ฮฮต ฮปฮนฮธฮนฮฟฮฑฯฮณฮนฮปฮนฮฟฯฮดฯฮฏฮดฮนฮฟ (LiAlH4):

ฮฃฯ
ฮผฯฯฮบฮฝฯฯฮท
ฮ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฮดฮฏฮฝฮตฮน ฯฮทฮผฮนฮบฮฎ ฮฑฮฝฯฮฏฮดฯฮฑฯฮท ฯฯ
ฮผฯฯฮบฮฝฯฯฮทฯ ฮผฮต ฮตฯฮฏฮดฯฮฑฯฮท ฮฝฮฑฯฯฮฏฮฟฯ
ฯฮต ฮฑฯฯฯฯฮนฮบฮฟฯฯ ฮดฮนฮฑฮปฯฯฮตฯ, ฯฯฮทฮผฮฑฯฮฏฮถฮฟฮฝฯฮฑฯ ฮฑฮนฮธฮฑฮฝฮฟฮดฮนฮฌฮปฮท ฮบฮฑฮน ฮผฮตฮธฮฑฮฝฮฟฮปฮนฮบฯ ฮฝฮฌฯฯฮนฮฟ (CH3ONa)[18]:

ฮงฮปฯฯฮฏฯฯฮท
ฮฯฯ ฮผฮตฮธฮฑฮฝฮนฮบฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑ ฮบฮฑฮน ฯฮปฯฯฮนฮฟ, ฯฮฑฯฮฟฯ
ฯฮฏฮฑ ฯ
ฯฮตฯฮนฯฮดฮฟฯ
ฯ ฮฑฮบฯฮนฮฝฮฟฮฒฮฟฮปฮฏฮฑฯ (UV), ฯฮฑฯฮฌฮณฮตฯฮฑฮน ฮดฮนฯฯฯฮณฮญฮฝฮนฮฟ:

ฮฯฮฑฯฮผฮฟฮณฮญฯ
ฮ ฮผฮตฮธฮฑฮฝฮนฮบฯฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑฯ ฯฯฮทฯฮนฮผฮฟฯฮฟฮนฮตฮฏฯฮฑฮน ฮบฯ
ฯฮฏฯฯ ฮณฮนฮฑ ฯฮทฮฝ ฯฮฑฯฮฑฮณฯฮณฮฎ ฮผฮตฮธฮฑฮฝฮฑฮผฮฏฮดฮนฮฟฯ
(HCONH2), ฮดฮนฮผฮตฮธฯ
ฮปฮฟฮผฮตฮธฮฑฮฝฮฑฮผฮฏฮดฮนฮฟฯ
[HCON(CH3)2] ฮบฮฑฮน ฮผฮตฮธฮฑฮฝฮนฮบฮฟฯ ฮฟฮพฮญฮฟฯ. ฮงฯฮทฯฮนฮผฮฟฯฮฟฮนฮตฮฏฯฮฑฮน ฮฑฮบฯฮผฮท ฯฯ ฮตฮฝฯฮฟฮผฮฟฮบฯฯฮฝฮฟ, ฮบฮฑฮธฯฯ ฮบฮฑฮน ฮณฮนฮฑ ฯฮทฮฝ ฯฮฑฯฮฑฯฮบฮตฯ
ฮฎ ฮดฮนฮฑฯฯฯฯฮฝ ฯฮฑฯฮผฮฑฮบฮตฯ
ฯฮนฮบฯฮฝ ฯฯฮฟฯฯฮฝฯฯฮฝ. ฮงฯฮทฯฮนฮผฮฟฯฮฟฮนฮฎฮธฮทฮบฮต ฮฑฮบฯฮผฮท ฯฯ ฯฯฮฟฯฮธฮทฯฮนฮบฯ ฮฑฮญฯฮนฮฟ ฮฑฯฯฮฟฯ, ฮฑฯฮฟฯ ฮญฯฮตฮน ฮผฮทฮดฮตฮฝฮนฮบฯ ฮดฯ
ฮฝฮฑฮผฮนฮบฯ ฮบฮฑฯฮฑฯฯฯฮฟฯฮฎฯ ฯฮถฮฟฮฝฯฮฟฯ ฮบฮฑฮน ฮผฮทฮดฮตฮฝฮนฮบฯ ฮดฯ
ฮฝฮฑฮผฮนฮบฯ ฯฮฑฮณฮบฯฯฮผฮนฮฑฯ ฮธฮญฯฮผฮฑฮฝฯฮทฯ, ฮฑฮฝฯฮนฮบฮฑฮธฮนฯฯฯฮฝฯฮฑฯ ฮฌฮปฮปฮฑ ฯฯฮฟฯฮธฮทฯฮนฮบฮฌ, ฯฯฯฯ ฯฮธฮฟฯฮฟฯฮปฯฯฮฌฮฝฮธฯฮฑฮบฮตฯ, ฮผฮต ฮฒฮปฮฑฮฒฮตฯฮฌ ฮฑฮฝฯฮฏฯฯฮฟฮนฯฮฑ ฮดฯ
ฮฝฮฑฮผฮนฮบฮฌ[19].
ฮฮนฮฑ ฯฮทฮฝ ฮนฯฯฮฟฯฮฏฮฑ, ฮผฮนฮฑ ฯฮฑฮปฮฑฮนฯฯฮตฯฮท ฮตฯฮฑฯฮผฮฟฮณฮฎ ฯฮฟฯ
ฮผฮตฮธฮฑฮฝฮนฮบฮฟฯ ฮผฮตฮธฯ
ฮปฮตฯฯฮญฯฮฑ, ฯฮฟฯ
ฮผฮตฯฮนฮบฮญฯ ฯฮฟฯฮญฯ ฯฯฮฑฮฒฮฌฮตฮน ฯฮทฮฝ ฯฯฮฟฯฮฟฯฮฎ, ฮตฮฏฮฝฮฑฮน ฯฯ ฯฯ
ฮบฯฮนฮบฯ ฯฮต ฮบฮฌฯฮฟฮนฮฑ ฮผฮฟฮฝฯฮญฮปฮฑ (ฮฟฮนฮบฮนฮฑฮบฯฮฝ) ฯฯ
ฮณฮตฮฏฯฮฝ ฯฯฯฯ ฯฮฟ ฮดฮนฮฌฯฮทฮผฮฟ GE Monitor Top, ฯฯฮนฮฝ ฮฑฮฝฯฮนฮบฮฑฯฮฑฯฯฮฑฮธฮตฮฏ ฮฑฯฯ ฮปฮนฮณฯฯฮตฯฮฟ ฯฮฟฮพฮนฮบฮฌ ฯฯ
ฮบฯฮนฮบฮฌ ฯ
ฮณฯฮฌ, ฯฯ ฮตฮฝฮฑฮปฮปฮฑฮบฯฮนฮบฯ ฮญฮฝฮฑฮฝฯฮน ฯฮฟฯ
ฮดฮนฮฟฮพฮตฮนฮดฮฏฮฟฯ
ฯฮฟฯ
ฮธฮตฮฏฮฟฯ
(SO2).
ฮ ฮทฮณฮญฯ
- ฮ. ฮฮปฮตฮพฮฌฮฝฮดฯฮฟฯ
, ฮฮตฮฝฮนฮบฮฎ ฮฯฮณฮฑฮฝฮนฮบฮฎ ฮงฮทฮผฮตฮฏฮฑ, ฮฮฮฃฮฃฮฮฮฮฮฮฮ 1985
- ฮ. ฮฮฌฯฮฒฮฟฮณฮปฮท, ยซฮงฮทฮผฮตฮฏฮฑ ฮฯฮณฮฑฮฝฮนฮบฯฮฝ ฮฮฝฯฯฮตฯฮฝยป, ฯฮฑฯฮฑฯฮทฯฮทฯฮฎฯ, ฮฮตฯฯฮฑฮปฮฟฮฝฮฏฮบฮท 1991
- SCHAUM'S OUTLINE SERIES, ฮฮกฮฮฮฮฮฮ ฮงฮฮฮฮฮ, ฮฯฯ. ฮ. ฮฮฌฯฮฒฮฟฮณฮปฮท, 1999
- ฮฯฮบฮฎฯฮตฮนฯ ฮบฮฑฮน ฯฯฮฟฮฒฮปฮฎฮผฮฑฯฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑฯ ฮ. ฮ. ฮ ฮตฯฮฌฯฮท 1982
- ฮ ฮฟฮปฯ
ฯฯฯฮฝฮท ฮฃ. ฮฮฑฯฮฑฮณฮบฮนฮฟฮถฮฏฮดฮท: ฮฮฝฮฟฮผฮฑฯฮฟฮปฮฟฮณฮฏฮฑ ฮฟฯฮณฮฑฮฝฮนฮบฯฮฝ ฮตฮฝฯฯฮตฯฮฝ, ฮฮตฯฯฮฑฮปฮฟฮฝฮฏฮบฮท 1991, ฮฮบฮดฮฟฯฮท ฮฮ.
- ฮ. ฮฮปฮตฮพฮฌฮฝฮดฯฮฟฯ
, ฮ. ฮฮฌฯฮฒฮฟฮณฮปฮท, ฮ. ฮฮนฮบฮฟฮปฮฑฮฮดฮท: ฮงฮทฮผฮตฮฏฮฑ ฮฯฮตฯฮฟฮบฯ
ฮบฮปฮนฮบฯฮฝ ฮฮฝฯฯฮตฯฮฝ, ฮฮตฯฯฮฑฮปฮฟฮฝฮฏฮบฮท 1985, ฮฮบฮดฮฟฯฮท ฮฮ.
- ฮ. ฮฮนฮบฮฟฮปฮฑฮฮดฮท: ฮฮนฮดฮนฮบฮฌ ฮบฮตฯฮฌฮปฮฑฮนฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑ, ฮฮตฯฯฮฑฮปฮฟฮฝฮฏฮบฮท 1983.
ฮฮฝฮฑฯฮฟฯฮญฯ ฮบฮฑฮน ฯฮฑฯฮฑฯฮทฯฮฎฯฮตฮนฯ
- โ ฮ ฯฯฯฯ
ฯฮฟ:IDLH
- โ ฮฃฮทฮผฮตฮฏฯฯฮท: ฮฯ
ฯฯ ฮตฮฏฮฝฮฑฮน ฯฮนฮฟ ฯฯ
ฮฝฮทฮธฮนฯฮผฮญฮฝฮฟ ฮณฮนฮฑ ฯฮฟ ฮผฮตฮธฮฑฮฝฮนฮบฯ ฮฑฮนฮธฯ
ฮปฮตฯฯฮญฯฮฑ.
- โ Werner Reutemann and Heinz Kieczka "Formic Acid" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim.
- โ ฮคฮฑ ฮดฮตฮดฮฟฮผฮญฮฝฮฑ ฯฯฮฟฮญฯฯฮฟฮฝฯฮฑฮน ฮตฮฝ ฮผฮญฯฮตฮน ฮฑฯฯ ฯฮฟ ยซTable of periodic properties of thw Ellementsยป, Sagrent-Welch Scientidic Company ฮบฮฑฮน ฮฯฮบฮฎฯฮตฮนฯ ฮบฮฑฮน ฯฯฮฟฮฒฮปฮฎฮผฮฑฯฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑฯ ฮ. ฮ. ฮ ฮตฯฮฌฯฮท 1982, ฮฃฮตฮป. 34.
- โ ฮฅฯฮฟฮปฮฟฮณฮนฯฮผฮญฮฝฮฟ ฮฒฮฌฯฮท ฯฮฟฯ
ฮนฮฟฮฝฮนฯฮผฮฟฯ ฮฑฯฯ ฯฮฟฮฝ ฯฮฑฯฮฑฯฮฌฮฝฯ ฯฮฏฮฝฮฑฮบฮฑ
- โ Process Economics Reports, Review 88-1-1, Process Economics Program, SRI Consulting, California, 1999
- โ W. Couteau, J. Ramioulle, US Patent US4216339
- โ ฮฉฯ ฮผฮญฯฮฟ ฮฟฮพฮฏฮฝฮนฯฮทฯ ฯฯฮทฯฮนฮผฮฟฯฮฟฮนฮตฮฏฯฮฑฮน ฯฯ
ฮฝฮฎฮธฯฯ ฯฮฟ ฮธฮตฮนฮนฮบฯ ฮฟฮพฯ (H2SO4), ฮณฮนฮฑ ฮฝฮฑ ฮฑฯฮฟฯฯฮฟฯฮฌ ฯฮฟ ฯฮฑฯฮฑฮณฯฮผฮตฮฝฮฟ ฮฝฮตฯฯ (H2O) ฮบฮฑฮน ฮญฯฯฮน ฮฝฮฑ ฮผฮตฯฮฑฮบฮนฮฝฮตฮฏ ฯฮฟ ฯฮทฮผฮตฮฏฮฟ ฮนฯฮฟฯฯฮฟฯฮฏฮฑฯ ฯฮทฯ ฮฑฮผฯฮฏฮดฯฮฟฮผฮทฯ ฮฑฮฝฯฮฏฮดฯฮฑฯฮทฯ ฯฯฮฟฯ ฯฮฑ ฮดฮตฮพฮนฮฌ, ฮบฮฑฮน ฮญฯฯฮน ฮฝฮฑ ฯฮทฮฝ ฮบฮฌฮฝฮตฮน ฯฯฮฑฮบฯฮนฮบฮฌ ฮผฮฟฮฝฯฮดฯฮฟฮผฮท:
- โ ฮฯฮบฮฎฯฮตฮนฯ ฮบฮฑฮน ฯฯฮฟฮฒฮปฮฎฮผฮฑฯฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑฯ ฮ. ฮ. ฮ ฮตฯฮฌฯฮท 1982, ฯฮตฮป. 298, ยง13.3ฮ1.
- โ ฮฯฮบฮฎฯฮตฮนฯ ฮบฮฑฮน ฯฯฮฟฮฒฮปฮฎฮผฮฑฯฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑฯ ฮ. ฮ. ฮ ฮตฯฮฌฯฮท 1982, ฯฮตฮป. 298, ยง13.3ฮ2.
- โ ฮฯฮบฮฎฯฮตฮนฯ ฮบฮฑฮน ฯฯฮฟฮฒฮปฮฎฮผฮฑฯฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑฯ ฮ. ฮ. ฮ ฮตฯฮฌฯฮท 1982, ฯฮตฮป. 298, ยง13.3ฮ3.
- โ ฮฯฮบฮฎฯฮตฮนฯ ฮบฮฑฮน ฯฯฮฟฮฒฮปฮฎฮผฮฑฯฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑฯ ฮ. ฮ. ฮ ฮตฯฮฌฯฮท 1982, ฯฮตฮป. 306, ยง13.7.1.
- โ ฮฯฮบฮฎฯฮตฮนฯ ฮบฮฑฮน ฯฯฮฟฮฒฮปฮฎฮผฮฑฯฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑฯ ฮ. ฮ. ฮ ฮตฯฮฌฯฮท 1982, ฯฮตฮป. 306, ยง13.7.2.
- โ 14,0 14,1 ฮฯฮบฮฎฯฮตฮนฯ ฮบฮฑฮน ฯฯฮฟฮฒฮปฮฎฮผฮฑฯฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑฯ ฮ. ฮ. ฮ ฮตฯฮฌฯฮท 1982, ฯฮตฮป. 306, ยง13.7.3, ฯฯฮฟฯฮฑฯฮผฮฟฮณฮฎ ฮณฮนฮฑ ฮฑฮผฮนฮฝฯฮปฯ
ฯฮท.
- โ ฮคฮฟ ฯฮตฮปฮตฯ
ฯฮฑฮฏฮฟ ฮผฮต ฯ
ฮดฯฯฮปฯ
ฯฮท ฯฯฮทฮผฮฑฯฮฏฮถฮตฮน ฮผฮตฮธฮฑฮฝฯฮปฮท (CH3OH).
- โ ฮฯฮบฮฎฯฮตฮนฯ ฮบฮฑฮน ฯฯฮฟฮฒฮปฮฎฮผฮฑฯฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑฯ ฮ. ฮ. ฮ ฮตฯฮฌฯฮท 1982, ฯฮตฮป. 306, ยง13.7.4.
- โ ฮฯฮบฮฎฯฮตฮนฯ ฮบฮฑฮน ฯฯฮฟฮฒฮปฮฎฮผฮฑฯฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑฯ ฮ. ฮ. ฮ ฮตฯฮฌฯฮท 1982, ฯฮตฮป. 307, ยง13.7.5.
- โ ฮฯฮบฮฎฯฮตฮนฯ ฮบฮฑฮน ฯฯฮฟฮฒฮปฮฎฮผฮฑฯฮฑ ฮฯฮณฮฑฮฝฮนฮบฮฎฯ ฮงฮทฮผฮตฮฏฮฑฯ ฮ. ฮ. ฮ ฮตฯฮฌฯฮท 1982, ฯฮตฮป. 307, ยง13.7.7ฮฑ.
- โ United Nations Environment Program Rigid and Flexible Foams Technical Options Committee 2006 Assessment report. http://ozone.unep.org/teap/Reports/FTOC/ftoc_assessment_report06.pdf ฮฯฯฮตฮนฮฟฮธฮตฯฮฎฮธฮทฮบฮต 2011-07-21 ฯฯฮฟ Wayback Machine.