| Oxid draselný |
|---|
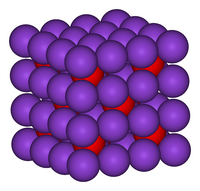 Model krystalové mřížky oxidu draselného |
| Obecné |
|---|
| Systematický název | oxid draselný |
|---|
| Latinský název | Dikalii oxidum |
|---|
| Anglický název | Potassium oxide |
|---|
| Německý název | Kaliumoxid |
|---|
| Sumární vzorec | K2O |
|---|
| Vzhled | světle žlutá pevná látka |
|---|
| Identifikace |
|---|
| Registrační číslo CAS | 12136-45-7 |
|---|
| EC-no (EINECS/ELINCS/NLP) | 235-227-6 |
|---|
| UN kód | 2033 |
|---|
| Vlastnosti |
|---|
| Molární hmotnost | 94,20 g/mol |
|---|
| Teplota rozkladu | >350 °C (vznik K2O2) |
|---|
| Hustota | 2,32 g/cm3 (0 °C)
2,35 g/cm3 |
|---|
| Rozpustnost ve vodě | reaguje za vzniku KOH |
|---|
| Struktura |
|---|
| Krystalová struktura | krychlová |
|---|
| Hrana krystalové mřížky | a=643,6 pm |
|---|
| Koordinační geometrie | čtyřstěnná (K+), krychlová (O2–) |
|---|
| Termodynamické vlastnosti |
|---|
| Standardní slučovací entalpie ΔHf° | −363,2 kJ/mol |
|---|
| Standardní molární entropie S° | 94,1 JK−1mol−1 |
|---|
| Standardní slučovací Gibbsova energie ΔGf° | −322,1 kJ/mol |
|---|
| Izobarické měrné teplo cp | 0,855 JK−1g−1 |
|---|
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa).
|
Oxid draselný (K2O) je sloučenina draslíku a kyslíku. Tato světle žlutá pevná látka, nejjednodušší oxid draslíku, se vyskytuje jen zřídka a je velmi reaktivní. Některé komerční výrobky, například hnojiva nebo cementy, se hodnotí podle procentního obsahu ekvivalentu K2O.
Výroba
Oxid draselný se vyrábí reakcí kyslíku a draslíku. Tato reakce poskytuje peroxid draselný, K2O2. Další reakcí tohoto peroxidu s draslíkem vzniká oxid[1]:
- K2O2 + 2 K → 2 K2O
Jinou a častěji používanou metodou je syntéza zahříváním dusičnanu draselného s kovovým draslíkem:
- 2 KNO3 + 10 K → 6 K2O + N2
Oxid draselný nelze získat dehydratací hydroxidu draselného.[zdroj?]
Vlastnosti a reakce
K2O krystalizuje v antifluoritové struktuře. Zde jsou pozice kladných a záporných iontů obráceny oproti pozicím ve fluoridu vápenatém (fluoritu), ionty draslíku mají okolo sebe vždy čtyři oxidové ionty, každý oxidový iont pak osm iontů draslíku[2][3]. K2O je zásaditým oxidem a bouřlivě reaguje s vodou za vzniku hydroxidu draselného:
K2O + H2O → 2 KOH.
Je navlhavý a pohlcuje vodu ze vzduchu, čímž dochází ke zmíněné prudké reakci.
Oxid draselný v hnojivech
Chemický vzorec K2O se používá v číslech N-P-K (dusík-fosfor-draslík) při označování hnojiv. Přestože K2O je vzorec pro oxid draselný, tato sloučenina není ve hnojivech obsažena. Jako zdroj draslíku se používá chlorid, síran nebo uhličitan draselný. Procentní obsah K2O pouze udává množství draslíku ve hnojivu, přepočtený na oxid draselný. V K2O je cca 83 % draslíku (hmotnostně), ovšem například chlorid draselný ho obsahuje jen 52 %. Poskytuje tedy méně draslíku než stejné množství oxidu draselného. Proto, pokud hnojivo obsahuje 30 % chloridu draselného, označuje se standardně jako devatenáctiprocentní.
Reference
V tomto článku byl použit překlad textu z článku Potassium oxide na anglické Wikipedii.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Zintl, E.; Harder, A.; Dauth B. Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums. Z. Elektrochem. Angew. Phys. Chem.. 1934, s. 588–93. Je zde použita šablona
{{Citation}} označená jako k „pouze dočasnému použití“.
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy