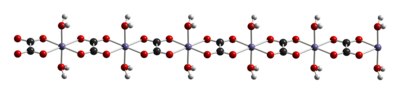
Sắt(II) oxalat
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

Solomon J. HottensteinLahir5 Mei 1844Lehigh County, PennsylvaniaMeninggal24 Mei 1896Manassas, VirginiaDikebumikanManassas CemeteryKesatuan107th Pennsylvania InfantryPerang/pertempuranPerang Saudara AmerikaPenghargaanMedal of HonorPasanganRebecca ClarkAnak7 Solomon Joseph Hottenstein (5 Mei 1844 – 24 Mei 1896) adalah seorang prajurit Amerika Serikat dan anggota 107th Pennsylvania Infantry yang berjuang dalam Perang Saudara Amerika dan dianugerahi Medal of Honor karena merebut b...

List of Bangladesh Army generals This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: List of serving generals of the Bangladesh Army – news · newspapers · books · scholar · JSTOR (January 2022) (Learn how and when to remove this template message) Flag of the Bangladesh Army This is a list of the serving generals...

Presiden Republik Islam IranStempel Administrasi Kepresidenan IranPetahanaEbrahim Raisisejak 3 Agustus 2021GelarBapak/Tuan Presiden Yang Mulia[1]StatusKepala pemerintahanAnggotaKabinetDewan Kemanfaatan dan KebijaksanaanDewan Keamanan Nasional TertinggiDewan Tertinggi Revolusi KebudayaanKediamanAdministrasi Kepresidenan(bekerja)Istana Sa'dabad(upacara dan tempat tinggal)KantorPasteur, TehranDitunjuk olehPemilihan langsungMasa jabatan4 tahun, dapat diperpanjang 1 kaliPejabat perdan...

MF1Berkas:Midland F1 Racing logo.pngNama resmiMidland F1 RacingKantor pusatSilverstone, Northamptonshire, Britania RayaPendiriAlex ShnaiderStaf terkenalColin KollesJames KeyPembalap terkenal Tiago Monteiro Christijan AlbersNama sebelumnyaJordan Grand PrixNama selanjutnyaSpyker F1 TeamSejarah dalam ajang Formula SatuMesinToyotaGelar Konstruktor0Gelar Pembalap0Jumlah lomba18Menang0Posisi pole0Putaran tercepat0Lomba pertamaGrand Prix Bahrain 2006Lomba terakhirGrand Prix Brasil 2006 Midland F1 R...

This article has multiple issues. Please help improve it or discuss these issues on the talk page. (Learn how and when to remove these template messages) This article includes a list of general references, but it lacks sufficient corresponding inline citations. Please help to improve this article by introducing more precise citations. (April 2016) (Learn how and when to remove this template message) This article is missing information about date of creation and other background or history of ...

Halaman ini berisi artikel tentang provinsi di Indonesia. Untuk pulau, lihat Pulau Papua. Untuk wilayah Indonesia, lihat Papua (wilayah Indonesia). Untuk kegunaan lain, lihat Papua (disambiguasi). Papua Irian Barat[a]Irian Jaya[b]Mamta[1]—SaireriProvinsi Otonomi KhususDari atas; kiri ke kanan: Jembatan Youtefa Jayapura, Pawai di Biak, Festival Danau Sentani, Papeda, Burung Cenderawasih, Burung Mambruk Victoria BenderaLambangMotto: Karya swadaya(Sanskerta) Bekerj...

Assassin's Creed UnityBerkas:Acunity.jpg PublikasiGenreLaga-petualanganLatar tempatAssassin's Creed universe Bahasa Daftar Arab, Belanda, Ceko, Inggris, Italia, Jepang, Jerman, Korea, Polandia, Portugis Brasil, Prancis, Rusia, Spanyol dan Tionghoa Tradisional 60 Karakteristik teknisPlatformXbox One, PlayStation 4 dan Windows MesinAnvilNext 2.0Modepermainan video multipemain dan Permainan video pemain tunggal Formatdistribusi digital dan unduhan digital Metode inputpapan tombol komputer Format...

Artikel ini perlu dikembangkan agar dapat memenuhi kriteria sebagai entri Wikipedia.Bantulah untuk mengembangkan artikel ini. Jika tidak dikembangkan, artikel ini akan dihapus. Maranhão adalah sebuah negara bagian Brasil. Maranhão berbatasan dengan Samudra Atlantik di sebelah utara. Negara bagian ini memiliki luas wilayah 333.366 km² dan populasi 5.642.960 jiwa. lbsNegara bagian di Brasil Distrik Federal: Distrik Federal Brasil Acre · Alagoas · Amapá · ...

This article may require copy editing for grammar, style, cohesion, tone, or spelling. You can assist by editing it. (April 2024) (Learn how and when to remove this message) Indonesian television business news network Television channel CNBC IndonesiaCountryIndonesiaBroadcast areaNationwideNetworkCNBCHeadquartersTrans Media BuildingJalan Kapten Pierre Tendean No. 12-14A, Mampang Prapatan, South JakartaProgrammingLanguage(s)IndonesianPicture format1080i HDTV 16:9OwnershipOwnerPT Trans Berita B...

Cultural center in Barcelona The CCCB in 2007 The Centre de Cultura Contemporània de Barcelona (also known by its acronym, CCCB) is an arts centre in Barcelona, Catalonia, Spain. Situated in the Raval district, the centre's core theme is the city and urban culture. The CCCB organizes exhibitions, debates, festivals and concerts, film cycles, courses, lectures, and other activities.[1] Activities Situated in the Raval district, the centre's core theme is the city and urban culture. Th...

Smt. Sumati Morarjeeश्रीमती सुमती मोरारजीNama asalJamuna (यमुना)Lahir(1909-03-13)13 Maret 1909BombayMeninggal27 Juni 1998(1998-06-27) (umur 89)Dikenal atasPerusahaan Navigasi Uap ScindiaSuami/istriShanti Kumar Narottam MorarjeePenghargaanPadma Vibhushan (1971)Catatan [1] Sumati Morarjee (13 Maret 1909 – 27 Juni 1998[2][3]), yang juga dikenal sebagai wanita perkapalan India pertama, dianggap menj...

بوسو أليغري بوسو أليغري بوسو أليغري خريطة الموقع تقسيم إداري البلد البرازيل [1] التقسيم الأعلى ميناس جرايس خصائص جغرافية إحداثيات 22°13′41″S 45°56′01″W / 22.228055555556°S 45.933611111111°W / -22.228055555556; -45.933611111111 [2] المساحة 543٫068 كيلومتر مربع الارتفاع 83...
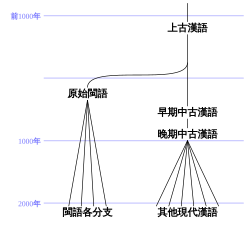
原始漢語Proto-Chinese, Proto-Sinitic, Primitive Chinese重建自漢語族區域古華夏時代公元前十六世紀以前[1][2]重建之祖語原始漢藏語 下層重建 上古漢語 原始閩語? 文字陶文(存在争议) 漢語發展演變簡圖 原始漢語(英語:Proto-Sinitic language),是原始漢族使用的一種祖語,歷史語言學假設所有漢語都擁有共同始祖,並根據這個假設來重建出這種語言。學者一般相信,原始...

1965 studio album by Herbie MannMy Kinda GrooveStudio album by Herbie MannReleased1965RecordedApril 6 and May 6, 7 & 8, 1964 New York CityGenreJazzLabelAtlanticSD 1433ProducerNesuhi ErtegunHerbie Mann chronology Latin Fever(1964) My Kinda Groove(1965) Herbie Mann Plays The Roar of the Greasepaint – The Smell of the Crowd(1965) My Kinda Groove is an album by American jazz flautist Herbie Mann recorded for the Atlantic label and released in 1965.[1] Reception Professional ...

歙(shè)州,中国隋朝时设置的州。 开皇九年(589年),隋灭陈后,改新安郡为歙州。原属新安郡的歙县、黟县、遂安县废。治所在海宁县(今安徽省休宁县万安镇)。开皇十一年(591年),复置歙县、黟县。开皇十八年(598年),改海宁县为休宁县。仁寿中,复置遂安县,属睦州。大业三年(607年),改歙州为新安郡,十三年(617年),移治歙县(今安徽省歙县)。辖境...

American political philosophy This article is part of a series onConservatismin the United States Schools Compassionate Fiscal Fusion Libertarian Moderate Movement Neo- Paleo- Postliberal Progressive Social Straussian Traditionalist Principles American exceptionalism Anti-communism Christian nationalism Civil religion Classical liberalism Communitarianism Constitutionalism Culture of life Pro-life Familialism Family values Federalism States' rights Gender essentialism Complementarianism Judeo...

Pinchas Menachem AlterGerrer RebbeMulai7 Juli 1992Berakhir7 Maret 1996PendahuluSimcha Bunim AlterPengganti1. Yaakov Aryeh Alter (sebagai Rebbe Gerrer), 2. Shaul Alter (sebagai Rosh Yeshiva Gerrer)Penjelasan pribadiLahir(1926-06-09)9 Juni 1926Falenica, dekat Warsawa, PolandiaWafat7 Maret 1996(1996-03-07) (umur 69)YerusalemDimakamkan7 Maret 1996 Yeshiva Sfas Emes, YerusalemDinastiGerOrangtuaAvraham Mordechai Alter Feyge Mintshe BidermanPasanganTzipora AlterAnak-anakEsther LiplMoshe Betzale...

Bendungan Mauvoisin . Pembangkit listrik tenaga air merupakan sumber energi listrik terpenting di Swiss . Sektor energi di Swiss mirip dengan negara-negara maju lainnya.[1] Selain tenaga air dan biomassa, negara ini tidak memiliki banyak sumber energi di wilayahnya: minyak bumi, gas, dan bahan bakar nuklir diimpor dari luar negeri. Strategi energi 2050 Pada 21 Mei 2017, rakyat Swiss menerima UU Energi baru yang menetapkan 'strategi energi 2050'. Tujuan dari strategi energi 2050 adala...

نيو جيو بوكيت كولرالشعارمعلومات عامةالنوع مشغل ألعاب فيديو محمول الصانع شين نيهون كوكاكي عائلة المنتج Neo Geo (en) الجيل الجيل السادس من أنظمة ألعاب الفيديو السعر المبدئي 69٫95 دولار أمريكي أهم التواريختاريخ الإصدار 16 مارس 1999 في اليابان6 أغسطس 1999 في أمريكا الشمالية...

Тигровая акула Научная классификация Домен:ЭукариотыЦарство:ЖивотныеПодцарство:ЭуметазоиБез ранга:Двусторонне-симметричныеБез ранга:ВторичноротыеТип:ХордовыеПодтип:ПозвоночныеИнфратип:ЧелюстноротыеКласс:Хрящевые рыбыПодкласс:ЭвселяхииИнфракласс:Пластиножабе�...