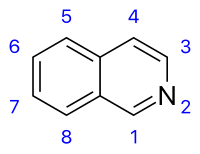
Isoquinolina
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

كفر محمود شاويش - قرية مصرية - تقسيم إداري البلد مصر المحافظة محافظة الشرقية المركز الزقازيق المسؤولون السكان التعداد السكاني 634 نسمة (إحصاء 2006) معلومات أخرى التوقيت ت ع م+02:00 تعديل مصدري - تعديل قرية كفر محمود شاويش هي إحدى القرى التابعة لمركز الزقازي�...

本條目存在以下問題,請協助改善本條目或在討論頁針對議題發表看法。 此條目需要补充更多来源。 (2018年3月17日)请协助補充多方面可靠来源以改善这篇条目,无法查证的内容可能會因為异议提出而被移除。致使用者:请搜索一下条目的标题(来源搜索:羅生門 (電影) — 网页、新闻、书籍、学术、图像),以检查网络上是否存在该主题的更多可靠来源(判定指引)。 �...
National monument in southeastern Arizona Chiricahua National MonumentIUCN category V (protected landscape/seascape)Rock formation on Echo Canyon TrailLocation in the United StatesShow map of ArizonaLocation in ArizonaShow map of the United StatesLocationCochise County, Arizona, United StatesNearest cityWillcox, ArizonaCoordinates32°00′20″N 109°21′24″W / 32.00569°N 109.35672°W / 32.00569; -109.35672Area12,025 acres (48.66 km2)[1]CreatedApr...

В Википедии есть статьи о других людях с фамилиями Каменев и Розенфельд. Лев Борисович КаменевЛев Розенфельд член Политбюро ЦК РКП(б) и председатель СТО Л.Б. Каменев Председатель Всероссийского ЦИК 27 октября (9 ноября) — 8 (21) ноября 1917 Глава правительства Владимир Ленин...

Voce principale: Unione Sportiva Catanzaro. Unione Sportiva CatanzaroStagione 1964-1965Sport calcio Squadra Catanzaro Allenatore Leandro Remondini Presidente Nicola Ceravolo Serie B8º posto Coppa ItaliaPrimo turno Maggiori presenzeCampionato: Provasi (38) Miglior marcatoreCampionato: Marchioro (9) 1963-1964 1965-1966 Si invita a seguire il modello di voce Questa pagina raccoglie le informazioni riguardanti l'Unione Sportiva Catanzaro nelle competizioni ufficiali della stagione 1964-196...

اضغط هنا للاطلاع على كيفية قراءة التصنيف السلحفاة المصرية حالة الحفظ أنواع مهددة بالانقراض (خطر انقراض أقصى) [1] المرتبة التصنيفية نوع[2] التصنيف العلمي النطاق: حقيقيات النوى المملكة: الحيوانات الشعبة: الحبليات الطائفة: الزواحف الرتبة: سلحفيات الشكل الفصيلة: الس...

Kediat Idjil Berg Kediat Idjil fotograferat från rymden Land Mauretanien Höjdläge 915 m ö.h. Koordinater 22°32′25″N 12°35′22″V / 22.54028°N 12.58944°V / 22.54028; -12.58944 Geologi Magnetit Geonames 2378941 Kediat Idjil markerat på kartan. Kediat Idjil markerat på kartan. Kediat Idjil är ett berg i regionen Tiris Zemmour i det nordvästafrikanska landet Mauretanien, med staden Zouérat på sin östra sida och F'Dérik på den västra...

Untuk kapal lain dengan nama serupa, lihat Kapal tempur Haruna. Haruna pada tahun 1934, setelah dikonstruksi ulang Sejarah Kekaisaran Jepang Nama HarunaAsal nama Gunung HarunaDipesan 1911Pembangun Galangan Kapal KawasakiPasang lunas 16 Maret 1912Diluncurkan 14 Desember 1913Mulai berlayar 19 April 1915Nasib Tenggelam saat tertambat pada 28 Juli 1945; diangkat dan dibongkar pada 1946[1] Ciri-ciri umum Kelas dan jenis Kapal tempur kelas-KongōBerat benaman 36.600 ton panjang (37.187 ...

Ruby Lake National Wildlife RefugeIUCN category IV (habitat/species management area)Location of the wildlife refugeShow map of the United StatesRuby Lake National Wildlife Refuge (Nevada)Show map of NevadaLocationElko County, White Pine County, Nevada, United StatesCoordinates40°12′07″N 115°29′35″W / 40.202°N 115.493°W / 40.202; -115.493Area39,928 acres (161.58 km2)Established1938Governing bodyU.S. Fish and Wildlife ServiceWebsiteRuby Lake Nationa...

1995 novel by John David Morley The Anatomy Lesson First Edition (US)AuthorJohn David MorleyLanguageEnglishGenreFiction, Bildungsroman, PhilosophicalPublisherAbacus Books (UK)St. Martin's Press (US)Publication date1995Media typePrint (Hardback & Paperback)Pages184 (US Hardback)ISBN0-349-10628-2 (UK)0-312-13426-6 (US) The Anatomy Lesson (1995) is a novel by John David Morley, inspired by Rembrandt’s painting The Anatomy Lesson of Dr. Nicolaes Tulp. Summary In Amsterdam, the streetw...

Pemandangan Freudenberg (Baden) dari puri Freudenberg (juga: Freudenberg am Main) merupakan nama dari sebuah munisipalitas di distrik Main-Tauber-Kreis, Baden-Württemberg, Jerman. Wilayah ini memiliki populasi sekitar 3.700 jiwa. Freudenberg terletak di ujung timur laut negara bagian Baden-Württemberg, di tepi kiri Sungai Main yang merupakan perbatasan ke Bayern. Pada tahun 1806 Freudenberg menjadi bagian dari Keharyapatihan Baden,[1] di seberang sungai adalah munisipalitas Collenbe...

محتوى هذه المقالة بحاجة للتحديث. فضلًا، ساعد بتحديثه ليعكس الأحداث الأخيرة وليشمل المعلومات الموثوقة المتاحة حديثًا. غيّرت سنرايز اسمها إلى بانداي نامكو فيلمووركز. ومع ذلك، يتم الاحتفاظ باسم سنرايز كعلامة تجارية لها.. (أبريل 2022) سنرايز株式会社バンダイナムコフィルムワークス (بالي�...

هذه المقالة عن مفهوم إسلامي عن المجتمع والفرد قبل الإسلام. لأحوال العرب السياسية والاقتصادية والثقافية والاجتماعية في شبه الجزيرة العربية والمناطق التي سكنها العربُ قديماً قبل انتشار الإسلام، طالع العرب قبل الإسلام. جزء من سلسلة مقالات حولالإسلام العقيدة الإيمان ...

Deputy Prime Minister of the United Kingdom from 1997 to 2007 For other people named John Prescott, see John Prescott (disambiguation). The Right HonourableThe Lord PrescottOfficial portrait, c. 1997Deputy Prime Minister of the United KingdomIn office2 May 1997 – 27 June 2007Prime MinisterTony BlairPreceded byMichael HeseltineSucceeded byNick Clegg[a]Deputy Leader of the Labour PartyIn office21 July 1994 – 24 June 2007LeaderTony BlairPreceded byMargare...

梅拉蒂·达伊瓦·奥克塔维亚尼Melati Daeva Oktavianti基本資料代表國家/地區 印度尼西亞出生 (1994-10-28) 1994年10月28日(29歲)[1] 印度尼西亞万丹省西冷[1]身高1.68米(5英尺6英寸)[1]握拍右手[1]主項:女子雙打、混合雙打職業戰績48勝–27負(女雙)109勝–56負(混雙)最高世界排名第4位(混雙-普拉文·喬丹)(2020年3月17日[2])現時世界排名第...

Tamil heptatonic scale This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Pann – news · newspapers · books · scholar · JSTOR (March 2023) (Learn how and when to remove this message)This article may need to be rewritten to comply with Wikipedia's quality standards. You can help. The talk page may contain suggest...

Universitas HarvardLambang Universitas Harvardbahasa Latin: Universitas HarvardianaMotoVeritas[1]Moto dalam bahasa InggrisTruthJenisSwasta – PenelitianDidirikan1636 (1636)[2]Dana abadi$36.4 milyar[3]PresidenDrew Gilpin FaustStaf akademik4,671[4]Jumlah mahasiswa21,000[5]Sarjana6,700[5]Magister14,500[5]LokasiCambridge, Massachusetts, A.S.KampusPerkotaan210 ekar (85 ha) (Kampus utama)21 ekar (8,5 ha) (Kampus medis)...

Palazzo del ReichstagBundestagLocalizzazioneStato Germania LocalitàBerlino IndirizzoPlatz der Republik 1 Coordinate52°31′06.96″N 13°22′33.6″E52°31′06.96″N, 13°22′33.6″E Informazioni generaliCondizioniIn uso Costruzione1884-1894 Inaugurazione1894 Stileneorinascimentale e moderno UsoSede ufficiale del Bundestag Altezza47 m Area calpestabile61,166 m² RealizzazioneArchitettoPaul WallotNorman Foster (Ricostruzione) ProprietarioStato tedesco CommittenteReich tedesco Modif...

فيلمافينيتيالشعارمعلومات عامةموقع الويب filmaffinity.com (الإنجليزية) نوع الموقع موقع ويب — قاعدة بيانات أفلام التأسيس 2002 الجوانب التقنيةاللغة الإنجليزية — الإسبانية[1] ترتيب أليكسا 2٬007[2](9 يناير 2018) تعديل - تعديل مصدري - تعديل ويكي بيانات فيلمافينيتي هو موقع توصيات أفلا�...

Pascal SimonNazionalità Francia Altezza171 cm Ciclismo SpecialitàStrada, Ciclocross Termine carriera1991 CarrieraSquadre di club 1979-1986 Peugeot1987 Z1988 Système U1989 Super U1991 Castorama Nazionale 1982-1984 Francia Modifica dati su Wikidata · Manuale Pascal Simon (Mesnil-Saint-Loup, 27 settembre 1956) è un ex ciclista su strada e ciclocrossista francese, vincitore di una tappa e del Premio della Combattività al Tour de France 1988, indoss�...