レナード-ジョーンズ・ポテンシャル (英 : Lennard-Jones potential )[ 1] [ 2] 原子 間の相互作用ポテンシャルエネルギー を表す経験的なモデルの一つである。ポテンシャル曲線を表す式が簡単で扱いやすいので、分子動力学 計算など、様々な分野において使われる。その名はレナード-ジョーンズ にちなむ。
レナード-ジョーンズ・ポテンシャルは、実際のポテンシャル曲線を表現するための簡便な手法であり、少数のパラメータ を用いたフィッティング に相当するため厳密ではない。しかし、問題の種類によっては、この方法で十分な場合がかなり多い。レナード-ジョーンズ・ポテンシャルに用いるパラメータは、実験的に求められた第二ビリアル係数 、粘性係数 、熱伝導率 などから、推定することができる。他の原子間の相互作用のモデルポテンシャルとしては、モースポテンシャル (Morse potential)等が挙げられる。
図 1 . レナード-ジョーンズ・ポテンシャルの例[ 3] オングストローム )を、縦軸はポテンシャルエネルギーを表す。2つのアルゴン原子間のポテンシャルが赤い実線で、これをレナード-ジョーンズ・ポテンシャルでフィッティングしたものが青い点線である。両者はよく一致しており、レナード-ジョーンズ・ポテンシャルが実際のポテンシャルをうまく再現できることが分かる。レナード-ジョーンズ・ポテンシャル
U
(
r
)
{\displaystyle U(r)}
U
(
r
)
=
4
ϵ ϵ -->
[
(
σ σ -->
r
)
p
− − -->
(
σ σ -->
r
)
q
]
{\displaystyle U(r)=4\epsilon \left[\left({\frac {\sigma }{r}}\right)^{p}-\left({\frac {\sigma }{r}}\right)^{q}\right]}
ここで、
r
{\displaystyle r}
σ σ -->
{\displaystyle \sigma }
ϵ ϵ -->
{\displaystyle \epsilon }
フィッティングパラメータ (物理学的な意味は後述)で、これと、次数p,qを定めることによってレナード-ジョーンズ・ポテンシャルが一意に決まる。
特に引力項の次数q = 6、斥力項の次数p = 12とした
U
(
r
)
=
4
ϵ ϵ -->
[
(
σ σ -->
r
)
12
− − -->
(
σ σ -->
r
)
6
]
{\displaystyle U(r)=4\epsilon \left[\left({\frac {\sigma }{r}}\right)^{12}-\left({\frac {\sigma }{r}}\right)^{6}\right]}
を、(6,12)ポテンシャルという。(6,12)ポテンシャルは、レナード-ジョーンズ・ポテンシャルの代表例である。以降、(6,12)ポテンシャルのことを、レナード-ジョーンズ・ポテンシャルとして説明する。
U
(
r
)
=
A
r
− − -->
12
− − -->
B
r
− − -->
6
{\displaystyle U(r)=Ar^{-12}-Br^{-6}}
ここで、−6乗の引力項は、二つの原子の間の分散力 、すなわち双極子 -双極子間の相互作用によるものである。原子の永久双極子 がゼロであっても、短時間をとった場合は電荷分布の揺らぎによる双極子が現れる。この双極子の電場により、もう一方の原子が分極し、誘起双極子 が生じる。この相互作用ポテンシャルは原子間距離の-6乗に比例したものとなる。
一方、−12乗の斥力項は、電子雲 の重なりによって反発力が働くためである。指数の−12は、−6乗のちょうど2乗で扱いやすいために選ばれることが多い。反発力の主な機構は、パウリの排他律 によって、低いエネルギーの分子軌道 に電子が入れないためである。
(1),(2)式より、
σ σ -->
{\displaystyle \sigma }
次元 を持ち、
r
=
σ σ -->
{\displaystyle r=\sigma }
σ σ -->
{\displaystyle \sigma }
ϵ ϵ -->
{\displaystyle \epsilon }
フィッティングパラメータ
σ σ -->
{\displaystyle \sigma }
ϵ ϵ -->
{\displaystyle \epsilon }
これらのパラメータは粒子-粒子間の相互作用であるため、厳密には特定の物質が持つ物性 ではない。理想的には全ての粒子種の組み合わせ(100を越える原子についてはおよそ5000組、ユナイテッドアトム・モデル まで拡張するとさらに増える)について、その全てが実験的事実から検討されることが望ましいが、現実的ではない。そのため、同種の粒子間力に関するパラメータを実験的に得て、ローレンツ-ベルテロ則 を用いるなどして異種粒子間のパラメータを推算することが一般となっている。
ここで、原子の相対運動において角運動量 がない(回転による遠心力 がない)とした場合の、平衡原子間距離について考察する。(2)式を原子間距離
r
{\displaystyle r}
F
(
r
)
{\displaystyle F(r)}
F
(
r
)
=
− − -->
d
d
r
U
(
r
)
=
4
ϵ ϵ -->
(
12
σ σ -->
12
r
13
− − -->
6
σ σ -->
6
r
7
)
{\displaystyle F(r)=-{\frac {d}{dr}}U(r)=4\epsilon \left(12\,{\frac {{\sigma }^{12}}{r^{13}}}-6\,{\frac {{\sigma }^{6}}{r^{7}}}\right)}
(4)式で与えられる平衡原子間距離
r
0
{\displaystyle r_{0}}
F
(
r
0
)
=
0
{\displaystyle F(r_{0})=0}
r
0
=
2
1
/
6
σ σ -->
{\displaystyle r_{0}=2^{1/6}\sigma }
また、(2)式を
r
{\displaystyle r}
r
=
r
0
{\displaystyle r=r_{0}}
r
0
{\displaystyle r_{0}}
格子定数 は、この
r
0
{\displaystyle r_{0}}
次に、
ϵ ϵ -->
{\displaystyle \epsilon }
σ σ -->
{\displaystyle \sigma }
U
(
r
)
=
ϵ ϵ -->
[
(
r
0
r
)
12
− − -->
2
(
r
0
r
)
6
]
{\displaystyle U(r)=\epsilon \left[\left({\frac {r_{0}}{r}}\right)^{12}-2\left({\frac {r_{0}}{r}}\right)^{6}\right]}
したがって、2原子間の距離が
r
=
r
0
{\displaystyle r=r_{0}}
U
(
r
0
)
=
− − -->
ϵ ϵ -->
{\displaystyle U(r_{0})=-\epsilon }
r
→ → -->
∞ ∞ -->
{\displaystyle r\rightarrow \infty }
U
(
r
)
→ → -->
0
{\displaystyle U(r)\rightarrow 0}
零点振動 を無視すれば、
ϵ ϵ -->
{\displaystyle \epsilon }
結合エネルギー (解離エネルギー )に相当することがわかる。
レナード-ジョーンズ・ポテンシャルは計算化学およびソフトマター物理学において基礎的な重要性を持つだけではなく、現実の物質のモデル化においても重要である。 レナード-ジョーンズ・ポテンシャルは物質のふるまいの基礎的研究および原子にまつわる現象を解明するためによく使われる。 また、(我々が属する3次元空間ではなく)2次元あるいは4次元空間の物質の熱物理学的性質の研究[ 4] [ 5] [ 6]
レナード-ジョーンズ・ポテンシャルは分子モデル化にも広く使われている。 レナード-ジョーンズ・ポテンシャルは、基本的には2つの方法で分子モデル化に使われる:(1) 実在の物質の原子あるいは分子をレナード-ジョーンズ・ポテンシャルで直接モデル化する方法。これにより希ガスおよびメタンのように分散相互作用する球形粒子については非常に良い結果が得られる。メタンの場合には、水素原子が炭素原子に融合して全体として一分子となり、分子が球対称であると見なす。もっと複雑な分子をこのように単純化することもできるが、通常は結果が良くない。 (2) 実在の物質の分子を複数のレナード-ジョーンズ相互作用サイトで構成する方法。これらのレナード-ジョーンズ相互作用サイトは固いボンドによる接続または追加ポテンシャルによる柔軟な接続で繋がれている。この方法を使って、実質的に全ての分子およびイオン性粒子に対する(「力場」と呼ばれることもある)分子モデルを構成できる。
方法(1)で利用する場合、分子モデルで使えるパラメータはレナード-ジョーンズ・ポテンシャルのパラメータ
ε ε -->
{\displaystyle \varepsilon }
σ σ -->
{\displaystyle \sigma }
ε ε -->
/
k
B
=
120
K
{\displaystyle \varepsilon /k_{\mathrm {B} }=120\,\mathrm {K} }
σ σ -->
=
0.34
n
m
{\displaystyle \sigma =0.34\,\mathrm {nm} }
ε ε -->
{\displaystyle \varepsilon }
σ σ -->
{\displaystyle \sigma }
還元単位のセクション 参照)を使うことでスケールして利用することができる。一般に、レナード-ジョーンズ・ポテンシャルのパラメータ
ε ε -->
{\displaystyle \varepsilon }
σ σ -->
{\displaystyle \sigma }
[ 7] [ 8]
細長く複雑な分子の構成ブロックとしてレナード-ジョーンズ・ポテンシャルを使う方法(2)はもっとずっと洗練されている。 これにより、分子モデルはこの特定の分子についてだけ適用できるものになる。この分子力場の開発アプローチは今日ではソフトマター物理およびそれに関連する分野である化学工学、化学、および計算生物学で実施されている。たとえば TraPPE力場 [ 9] [ 10] MolMod力場 [ 11] EAMポテンシャル [ 12]
無次元(還元)単位
量
記号
還元形
長さ
r
∗ ∗ -->
{\displaystyle r^{*}}
r
σ σ -->
{\displaystyle {\frac {r}{\sigma }}}
時間
t
∗ ∗ -->
{\displaystyle t^{*}}
t
ε ε -->
m
σ σ -->
2
{\displaystyle t{\sqrt {\frac {\varepsilon }{m\sigma ^{2}}}}}
温度
T
∗ ∗ -->
{\displaystyle T^{*}}
k
B
T
ε ε -->
{\displaystyle {\frac {k_{B}T}{\varepsilon }}}
力
F
∗ ∗ -->
{\displaystyle F^{*}}
F
σ σ -->
ε ε -->
{\displaystyle {\frac {F\sigma }{\varepsilon }}}
エネルギー
U
∗ ∗ -->
{\displaystyle U^{*}}
U
ε ε -->
{\displaystyle {\frac {U}{\varepsilon }}}
圧力
p
∗ ∗ -->
{\displaystyle p^{*}}
p
σ σ -->
3
ε ε -->
{\displaystyle {\frac {p\sigma ^{3}}{\varepsilon }}}
密度
ρ ρ -->
∗ ∗ -->
{\displaystyle \rho ^{*}}
ρ ρ -->
σ σ -->
3
{\displaystyle \rho \sigma ^{3}}
表面張力
γ γ -->
∗ ∗ -->
{\displaystyle \gamma ^{*}}
γ γ -->
σ σ -->
2
ε ε -->
{\displaystyle {\frac {\gamma \sigma ^{2}}{\varepsilon }}}
無次元還元単位はレナード-ジョーンズ・ポテンシャルのパラメータで定義できる。これらは分子シミュレーションで用いるのに便利である。数値計算の観点から見れば、 この単位系を使う利点として1に近い数を扱えること、方程式が単純になること、および結果をスケールすることが簡単になることがあげられる[ 13] [ 14]
σ σ -->
{\displaystyle \sigma }
ε ε -->
{\displaystyle \varepsilon }
m
{\displaystyle m}
一般に、長さパラメータおよびエネルギー・パラメータからなる他の分子相互作用についても、還元単位系を構成することができる。
レナード-ジョーンズ物質、つまりレナード-ジョーンズ・ポテンシャルで相互作用する粒子系の熱物理学的性質は、統計力学を使って得ることができる。いくつかの性質は解析的に計算できるが、ほとんどの性質は分子シミュレーション[ 14] [ 15] [ 16] [ 17] [ 18] [ 19] [ 15] [ 18]
V
L
J
(
r
)
{\displaystyle V_{\mathrm {LJ} }(r)}
F
=
− − -->
∇ ∇ -->
V
LJ
(
r
)
{\displaystyle {\boldsymbol {F}}=-{\boldsymbol {\nabla }}V_{\text{LJ}}(r)}
[ 20] [ 21]
レナード-ジョーンズ粒子は単純だが現実的な粒子間相互作用のモデル化の典型例であるため、多数の熱物理学的性質が研究され、文献に報告されている[ 16] 高速計算機械 」上での分子シミュレーションが可能になった[ 22] [ 23] [ 24] [ 16] [ 16] NIST website に示されている簡潔な選定データを扱う場合には、文献参照[ 25] NIST website に掲載されているデータの多くはNIST内の研究によるもので査読を受けていないデータである。
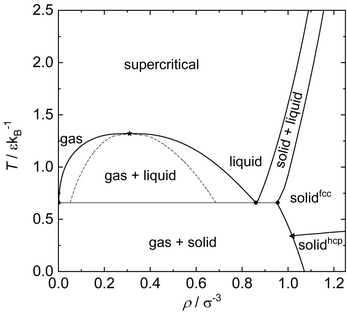
図 2 . レナード-ジョーンズ物質の相図。臨界点および三重点の数値は文献[ 16] [ 26] [ 27] [ 16] [ 26] [ 28] [ 16] [ 26] [ 27] 図2はレナード-ジョーンズ流体の相図である。レナード-ジョーンズ・ポテンシャルの相平衡はこれまでに何度も研究されており、そのため現在では精度よくわかっている[ 26] [ 16] [ 29]
レナード-ジョーンズ粒子の一粒子あたりの平均粒子間相互作用は熱力学的状態、つまり温度と圧力(または密度)に強く依存する。固体状態、特に低温ではレナード-ジョーンズ相互作用の引力的部分が支配的となる。液体状態では固体状態に比べて秩序の低い構造を取る。一粒子あたりのポテンシャル・エネルギーは負になる。期待状態では、粒子間距離が大きいため、レナード-ジョーンズ・ポテンシャルの引力相互作用の影響は小さい。気体状態における内部エネルギーの大半は運動エネルギーである。超臨界状態でもレナード-ジョーンズ相互作用の引力部分の効果は小さい。温度を上げると粒子の平均運動エネルギーは増加し、レナード-ジョーンズ・ポテンシャルのエネルギー井戸の大きさを超える。すると粒子は主にソフト斥力で相互作用するようになり、その結果として平均ポテンシャル・エネルギーは正になる。
全体的に言えば、レナード-ジョーンズ・ポテンシャルとその熱物理学的性質の研究と文献発表の歴史が長く、精密なシミュレーションを実施する計算資源が(現代の標準から見て)不足していたため、かなりの量のデータが疑わしいことが知られている[ 16]
レナード-ジョーンズ・ポテンシャルの最も重要な特性点は、臨界点および気体・液体・固体の三重点である。これらの点は文献で何度も研究されており、文献[ 16]
T
c
=
1.321
± ± -->
0.007
ε ε -->
k
B
− − -->
1
{\displaystyle T_{\mathrm {c} }=1.321\pm 0.007\,\varepsilon k_{\mathrm {B} }^{-1}}
ρ ρ -->
c
=
0.316
± ± -->
0.005
σ σ -->
− − -->
3
{\displaystyle \rho _{\mathrm {c} }=0.316\pm 0.005\,\sigma ^{-3}}
p
c
=
0.129
± ± -->
0.005
ε ε -->
σ σ -->
− − -->
3
{\displaystyle p_{\mathrm {c} }=0.129\pm 0.005\,\varepsilon \sigma ^{-3}}
にあると評価されている。
ここに与えた不確かさは、入手可能な気体・液体平衡に関する最も信頼できるデータセット[ 16]
T
t
r
=
0.69
± ± -->
0.005
ε ε -->
k
B
− − -->
1
{\displaystyle T_{\mathrm {tr} }=0.69\pm 0.005\,\varepsilon k_{\mathrm {B} }^{-1}}
ρ ρ -->
t
r
,
g
a
s
=
0.0017
± ± -->
0.004
σ σ -->
− − -->
3
{\displaystyle \rho _{\mathrm {tr,gas} }=0.0017\pm 0.004\,\sigma ^{-3}}
ρ ρ -->
t
r
,
l
i
q
=
0.845
± ± -->
0.009
σ σ -->
− − -->
3
{\displaystyle \rho _{\mathrm {tr,liq} }=0.845\pm 0.009\,\sigma ^{-3}}
ρ ρ -->
t
r
,
s
o
l
=
0.961
± ± -->
0.007
σ σ -->
− − -->
3
{\displaystyle \rho _{\mathrm {tr,sol} }=0.961\pm 0.007\,\sigma ^{-3}}
p
t
r
=
0.0012
± ± -->
0.0007
ε ε -->
σ σ -->
− − -->
3
{\displaystyle p_{\mathrm {tr} }=0.0012\pm 0.0007\,\varepsilon \sigma ^{-3}}
にあると考えられている。これらの不確かさは、著者ごとにデータがばらついていることを表してる[ 26]
図 3 . レナード-ジョーンズ物質の特性曲線。太い黒実線は気体・液体平衡線である。星印は臨界点である。茶色実線は固体・流体平衡線である。太くない黒実線と黒丸はレナード-ジョーンズ物質に関するブラウンの特性曲線(詳細は本文を参照)である:黒実線は状態方程式の結果、黒丸は分子シミュレーションの結果、および黒三角はヴィリアル係数から求めた理想気体極限の厳密なデータである。データは[ 30] [ 31] [ 32] 明らかに、相共存線(図2参照)はレナード-ジョーンズ・ポテンシャルを特徴づけるのに重要な基礎的性質である。さらに、ブラウンの特性曲線[ 33]
Z
=
p
/
ρ ρ -->
T
{\displaystyle Z=p/\rho T}
T
{\displaystyle T}
ρ ρ -->
{\displaystyle \rho }
Z
{\displaystyle Z}
Z
{\displaystyle Z}
ρ ρ -->
→ → -->
0
{\displaystyle \rho \rightarrow 0}
[ 31] [ 16] [ 30] [ 34] [ 35]
図3にブラウンの特性曲線を示した。ゼノ曲線
Z
{\displaystyle \mathrm {Z} }
Z
=
p
/
(
ρ ρ -->
T
)
=
1
{\displaystyle Z=p/(\rho T)=1}
T
B
=
3.417927982
ε ε -->
k
B
− − -->
1
{\displaystyle T_{\mathrm {B} }=3.417927982\,\varepsilon k_{\mathrm {B} }^{-1}}
[ 30]
B
{\displaystyle \mathrm {B} }
d
Z
d
(
1
/
ρ ρ -->
)
|
T
=
0
{\displaystyle \left.{\frac {\mathrm {d} Z}{\mathrm {d} (1/\rho )}}\right|_{T}=0}
d
Z
d
T
|
p
=
0
{\displaystyle \left.{\frac {\mathrm {d} Z}{\mathrm {d} T}}\right|_{p}=0}
d
T
d
p
|
h
=
0
{\displaystyle \left.{\frac {\mathrm {d} T}{\mathrm {d} p}}\right|_{h}=0}
T
=
6.430798418
ε ε -->
k
B
− − -->
1
{\displaystyle T=6.430798418\,\varepsilon k_{\mathrm {B} }^{-1}}
A
{\displaystyle \mathrm {A} }
d
Z
d
T
|
ρ ρ -->
=
0
{\displaystyle \left.{\frac {\mathrm {d} Z}{\mathrm {d} T}}\right|_{\rho }=0}
T
=
25.15242837
ε ε -->
k
B
− − -->
1
{\displaystyle T=25.15242837\,\varepsilon k_{\mathrm {B} }^{-1}}
[ 30]
図 4 . レナード-ジョーンズ物質の気液平衡:蒸気圧(上図)、飽和密度(中央図)、および界面張力(下図)。記号は分子シミュレーションの結果を示している[ 36] [ 16] [ 36] [ 27] ソフトマター物理およびそれに関連する分野でレナード-ジョーンズ・ポテンシャルは特に重要であるため、レナード-ジョーンズ流体の性質は文献で広く研究されている。2019年現在までに約50個の気液平衡に関する計算機実験結果のデータセットが公開されている[ 16] [ 16]
レナード-ジョーンズ物質の気液平衡における蒸気圧、飽和密度、および界面張力を図4に示した。蒸気圧について±1%、飽和液体密度について±0.2%、飽和蒸気密度について±1%、気化エンタルピーについて±0.75%、そして表面張力について±4%の精度(つまり熱力学的に整合性のあるデータの相互一致)で明らかになっている[ 16]
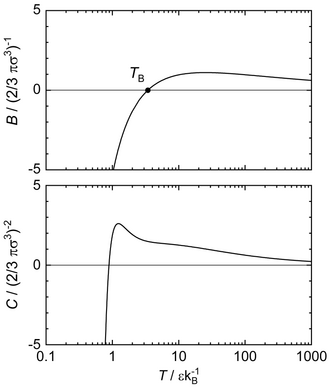
図 5 . 温度の関数としてのレナード-ジョーンズ・ポテンシャルの第2ヴィリアル係数
B
{\displaystyle B}
C
{\displaystyle C}
T
B
{\displaystyle T_{\mathrm {B} }}
[ 30] 相平衡の性質および任意の密度における一様状態の性質はどちらも、一般には分子シミュレーションでしか得ることができないが、ヴィリアル係数は直接レナード-ジョーンズ・ポテンシャルから計算できる[ 19] [ 37] [ 30] [ 16] [ 38] [ 39] [ 40] [ 41]
流体相に比べて、レナード-ジョーンズ固体に関するデータベースおよび知見は著しく貧弱である。これは、レナード-ジョーンズ・ポテンシャルを固体状態の物質のモデル化に利用することが少ないことが主な理由である。固相、特に金属固相の相互作用を二体加法的相互作用で近似すべきでないことが早くから知られていたからである[ 7] [ 8]
それでも、レナード-ジョーンズ・ポテンシャルは単純で計算効率がいいので固体状態物理で頻繁に利用される。固相および固液相平衡の基礎的性質に関して何度も研究がなされている[ 29] [ 26] [ 28] [ 42] [ 43] [ 32]
レナード-ジョーンズ物質は、温度および圧力に応じてfcc、hcp およびその他の最密多型格子を形成する(図2参照)。低温で圧力が低い側の領域では、hcpがエネルギー的に有利であるから平衡構造となる。fcc格子は高温かつ高圧でエネルギー的に有利であるから、より広範囲の状態で安定構造となる。fccとhcpの共存線は
T
=
0
{\displaystyle T=0}
p
=
878.5
ε ε -->
σ σ -->
− − -->
3
{\displaystyle p=878.5\,\varepsilon \sigma ^{-3}}
T
=
0.4
ε ε -->
k
B
− − -->
1
{\displaystyle T=0.4\,\varepsilon k_{\mathrm {B} }^{-1}}
T
=
0.32
ε ε -->
k
B
− − -->
1
{\displaystyle T=0.32\,\varepsilon k_{\mathrm {B} }^{-1}}
[ 42] [ 26]
2つの固相fcc、hcpおよび気相の三重点[ 42] [ 26]
T
t
r
=
0.32
± ± -->
0.001
ε ε -->
k
B
− − -->
1
{\displaystyle T_{\mathrm {tr} }=0.32\pm 0.001\,\varepsilon k_{\mathrm {B} }^{-1}}
ρ ρ -->
t
r
,
g
a
s
:
{\displaystyle \rho _{\mathrm {tr,gas} }:}
ρ ρ -->
t
r
,
f
c
c
=
1.03859
± ± -->
0.0008
σ σ -->
− − -->
3
{\displaystyle \rho _{\mathrm {tr,fcc} }=1.03859\pm 0.0008\,\sigma ^{-3}}
ρ ρ -->
t
r
,
h
c
p
=
1.03861
± ± -->
0.0007
σ σ -->
− − -->
3
{\displaystyle \rho _{\mathrm {tr,hcp} }=1.03861\pm 0.0007\,\sigma ^{-3}}
p
t
r
=
0.96
⋅ ⋅ -->
10
− − -->
9
ε ε -->
σ σ -->
− − -->
3
{\displaystyle p_{\mathrm {tr} }=0.96\cdot 10^{-9}\,\varepsilon \sigma ^{-3}}
である。
この値と大きく異なる値を報告している文献もあることに注意しておく。
図 6 . 二成分レナード-ジョーンズ混合系の気液平衡。ここに示した全ての図で成分2がより揮発性の高い(つまり気相で豊富な)成分である。また、全ての図で成分1の
ε ε -->
{\displaystyle \varepsilon }
σ σ -->
{\displaystyle \sigma }
T
=
0.92
ε ε -->
k
B
− − -->
1
{\displaystyle T=0.92\,\varepsilon k_{\mathrm {B} }^{-1}}
[ 36] レナード-ジョーンズ粒子の混合系は主に溶液に関する理論や手法の開発において典型的な系として使われることが多いが、一般の溶液の性質に関する研究にも使われる。その歴史は、ロングエト-ヒギンズ[ 44] [ 45] [ 46] [ 47] [ 48]
2成分以上のレナード-ジョーンズ混合系は、構成成分のポテンシャル・パラメータ(
ε ε -->
{\displaystyle \varepsilon }
σ σ -->
{\displaystyle \sigma }
ε ε -->
12
{\displaystyle \varepsilon _{\mathrm {12} }}
σ σ -->
12
{\displaystyle \sigma _{\mathrm {12} }}
ε ε -->
11
{\displaystyle \varepsilon _{\mathrm {11} }}
σ σ -->
11
{\displaystyle \sigma _{\mathrm {11} }}
ε ε -->
22
{\displaystyle \varepsilon _{\mathrm {22} }}
σ σ -->
22
{\displaystyle \sigma _{\mathrm {22} }}
[ 49] [ 50]
σ σ -->
12
=
η η -->
12
σ σ -->
11
+
σ σ -->
22
2
{\displaystyle \sigma _{12}=\eta _{12}{\frac {\sigma _{11}+\sigma _{22}}{2}}}
ε ε -->
12
=
ξ ξ -->
12
ε ε -->
11
ε ε -->
22
{\displaystyle \varepsilon _{12}=\xi _{12}{\sqrt {\varepsilon _{11}\varepsilon _{22}}}}
パラメータ
ξ ξ -->
12
{\displaystyle \xi _{12}}
σ σ -->
12
{\displaystyle \sigma _{12}}
η η -->
12
{\displaystyle \eta _{12}}
ξ ξ -->
12
{\displaystyle \xi _{12}}
k
12
=
1
− − -->
ξ ξ -->
12
{\displaystyle k_{12}=1-\xi _{12}}
ξ ξ -->
12
>
1
{\displaystyle \xi _{12}>1}
ξ ξ -->
12
<
1
{\displaystyle \xi _{12}<1}
レナード-ジョーンズ混合系に関しては、流体および固体相間(つまり気液、液液、気気、固気、固液、および固固)の相平衡が研究できる。したがって、異なるタイプの三重点(三相平衡)および臨界点に加えて、共晶点および共沸点が存在しうる[ 51] [ 48] [ 36] [ 52] [ 53] [ 54] [ 55] [ 56] [ 57] [ 58] [ 59] [ 60]
流体相では、
ξ ξ -->
12
=
1
{\displaystyle \xi _{12}=1}
ξ ξ -->
12
>
1
{\displaystyle \xi _{12}>1}
ξ ξ -->
12
<
1
{\displaystyle \xi _{12}<1}
ξ ξ -->
12
{\displaystyle \xi _{12}}
[ 58] [ 60] [ 57] [ 56]
最初のコンピュータ・シミュレーション[ 22] [ 27] [ 30]
レナード-ジョーンズ流体の状態方程式は、ソフトマター物理および物理化学の分野で非常に重要である。というのは、高分子や会合流体のような複雑流体の状態方程式を開発するときの出発点としてよく使われるからである。
文献では30以上のレナード-ジョーンズ状態方程式が提案されている。これらの状態方程式の包括的評価[ 27] [ 30] [ 61] [ 62] [ 63] [ 64] [ 62] [ 30] [ 27] [ 62] [ 65] [ 16] [ 27] [ 62] [ 65] [ 62]
図 7 . レナード-ジョーンズ・ポテンシャルの長距離相互作用に関する補正の収束を例示した。ここで
X
{\displaystyle X}
r
c
{\displaystyle r_{\mathrm {c} }}
X
c
o
r
r
{\displaystyle X_{\mathrm {corr} }}
X
t
r
u
e
{\displaystyle X_{\mathrm {true} }}
「真の」あるいは「完全な」レナード-ジョーンズ・ポテンシャル(1)は無限遠まで到達する。分子シミュレーションにおいてレナード-ジョーンズ・ポテンシャルで相互作用する粒子集団の観測可能量を評価する場合、システムサイズが有限であるために、ある有限の距離までしか相互作用を評価できない。このシミュレーションで用いる最大距離をカットオフ半径
r
c
{\displaystyle r_{\mathrm {c} }}
r
c
{\displaystyle r_{\mathrm {c} }}
シミュレーションにおける長距離相互作用の影響を考慮し、完全なポテンシャルに対する良い近似を得るためにさまざまな補正法が開発されている[ 66] [ 13]
X
{\displaystyle X}
X
c
o
r
r
{\displaystyle X_{\mathrm {corr} }}
X
s
a
m
p
l
e
d
{\displaystyle X_{\mathrm {sampled} }}
X
l
r
c
{\displaystyle X_{\mathrm {lrc} }}
U
c
o
r
r
=
U
s
a
m
p
l
e
d
+
U
l
r
c
{\displaystyle U_{\mathrm {corr} }=U_{\mathrm {sampled} }+U_{\mathrm {lrc} }}
[ 13]
X
t
r
u
e
{\displaystyle X_{\mathrm {true} }}
さらに、長距離補正法の質はカットオフ半径に依存する。カットオフ半径が非常に小さい場合、補正法が基づく仮定が通常は成立しない。この例を図7に示した。
図 8 . 完全なレナード-ジョーンズ・ポテンシャルの気液平衡線(黒線)およびレナード-ジョーンズ切断シフテッド・ポテンシャルの気液平衡線(青線)の比較。点は分子シミュレーションの結果[ 16] [ 67] [ 27] [ 68] レナード-ジョーンズ切断シフテッド(Lennard-Jones truncated and shifted, LJTS)ポテンシャルは完全なレナード-ジョーンズ・ポテンシャルの代わりに利用される。完全なレナード-ジョーンズ・ポテンシャルとLJTSポテンシャルは、異なる熱物理学的性質を持つポテンシャルとして厳密に分けて考えるべきである。LJTSポテンシャルの定義は
V
LJTS
(
r
)
=
{
V
LJ
(
r
)
− − -->
V
LJ
(
r
end
)
r
≤ ≤ -->
r
end
0
r
>
r
end
,
{\displaystyle V_{\text{LJTS}}(r)={\begin{cases}V_{\text{LJ}}(r)-V_{\text{LJ}}(r_{\text{end}})&~~~~r\leq r_{\text{end}}\\0&~~~~r>r_{\text{end}},\end{cases}}}
V
LJ
(
r
)
=
4
ε ε -->
[
(
σ σ -->
r
)
12
− − -->
(
σ σ -->
r
)
6
]
,
{\displaystyle V_{\text{LJ}}(r)=4\varepsilon \left[\left({\frac {\sigma }{r}}\right)^{12}-\left({\frac {\sigma }{r}}\right)^{6}\right],}
LJTSポテンシャルは距離
r
e
n
d
{\displaystyle r_{\mathrm {end} }}
V
L
J
(
r
e
n
d
)
{\displaystyle V_{\mathrm {LJ} }(r_{\mathrm {end} })}
r
e
n
d
{\displaystyle r_{\mathrm {end} }}
r
e
n
d
=
2.5
σ σ -->
{\displaystyle r_{\mathrm {end} }=2.5\,\sigma }
r
e
n
d
{\displaystyle r_{\mathrm {end} }}
[ 69] [ 70] [ 71] [ 72]
r
e
n
d
{\displaystyle r_{\mathrm {end} }}
LJTSポテンシャルは完全なレナード-ジョーンズ・ポテンシャルよりずっと計算コストがかからず、(臨界点および三重点の存在、非剛体斥力および引力、相平衡などの)物質の本質的物理的性質を保持している。そのため、LJTSポテンシャルは新しいアルゴリズム、シミュレーション法、および理論を試すために利用されることがよくある[ 73] [ 74] [ 75] [ 76]
LJTS物質の性質は、使用したシミュレーションのアルゴリズム、つまり分子動力学法あるいはモンテカルロ法の違いによって影響を受けることがある。一般に、このような違いは完全なレナード-ジョーンズ・ポテンシャルの場合には生じない。
r
e
n
d
=
2.5
σ σ -->
{\displaystyle r_{\mathrm {end} }=2.5\,\sigma }
− − -->
ε ε -->
{\displaystyle -\varepsilon }
V
L
J
(
r
e
n
d
=
2.5
σ σ -->
)
=
− − -->
0.0163
ε ε -->
{\displaystyle V_{\mathrm {LJ} }(r_{\mathrm {end} }=2.5\,\sigma )=-0.0163\,\varepsilon }
[ 77] [ 78] [ 79]
分子間ポテンシャルの典型であるレナード-ジョーンズ・ポテンシャルは、多くのもっと精巧で一般化された分子間ポテンシャルの開発の出発点として利用されてきた。レナード-ジョーンズ・ポテンシャルのさまざまな拡張および変更が文献で提案されている。以下に、レナード-ジョーンズ・ポテンシャルに直接関係していて、歴史的に重要かつ現在の研究でも価値あるいくつかのポテンシャルの例を挙げる。他のポテンシャル例は原子間ポテンシャル の記事にある。
ミー・ポテンシャル このポテンシャルは、レナード-ジョーンズ・ポテンシャルの指数12および6を、パラメータ
λ λ -->
r
e
p
{\displaystyle \lambda _{\mathrm {rep} }}
λ λ -->
a
t
t
r
{\displaystyle \lambda _{\mathrm {attr} }}
[ 80] [ 81] [ 82] [ 83] バッキンガム・ポテンシャル このポテンシャルはリチャード・バッキンガムが提案した。これはレナード-ジョーンズ・ポテンシャルの斥力項を指数関数に置き換え、パラメータを追加したものである。ストックマイヤー・ポテンシャル このポテンシャルは W. H. ストックマイヤーに因んで名付けられた。このポテンシャルはレナード-ジョーンズ・ポテンシャルに双極子を重ねたポテンシャルである。したがってストックマイヤー粒子は球対称ではなく方向依存性を持っている。二中心レナード-ジョーンズ・ポテンシャル このポテンシャルは、2つの等価な(つまり同じ
ε ε -->
,
σ σ -->
,
m
{\displaystyle \varepsilon ,\sigma ,m}
σ σ -->
{\displaystyle \sigma }
レナード-ジョーンズ切断スプラインド・ポテンシャル このポテンシャルは有用であるがほとんど使われていない。LJTSポテンシャルと同じくある距離
r
e
n
d
{\displaystyle r_{\mathrm {end} }}
^ Gordon M. Barrow (著), 大門 寛 (翻訳), 堂免 一成 (翻訳),“バーロー物理化学〈上〉”東京化学同人; 第6版 (1999/03)
^ キッテル (著)、宇野 良清、他(翻訳),“固体物理学入門 第8版”, 丸善 ,2005.12(ISBN 4621076531 )^ R. A. Aziz, J. Chem. Phys., vol. 99, 4518 (1993)
^ Smit, B.; Frenkel, D. (1991-04-15). “Vapor–liquid equilibria of the two‐dimensional Lennard‐Jones fluid(s)” . The Journal of Chemical Physics 94 (8): 5663–5668. Bibcode : 1991JChPh..94.5663S . doi :10.1063/1.460477 . ISSN 0021-9606 . https://aip.scitation.org/doi/10.1063/1.460477 . ^ Scalise, Osvaldo H (June 2001). “Type I gas–liquid equilibria of a two-dimensional Lennard–Jones binary mixture” . Fluid Phase Equilibria 182 (1–2): 59–64. doi :10.1016/s0378-3812(01)00380-6 . ISSN 0378-3812 . https://www.sciencedirect.com/science/article/abs/pii/S0378381201003806 . ^ Hloucha, M.; Sandler, S. I. (November 1999). “Phase diagram of the four-dimensional Lennard-Jones fluid” . The Journal of Chemical Physics 111 (17): 8043–8047. Bibcode : 1999JChPh.111.8043H . doi :10.1063/1.480138 . ISSN 0021-9606 . https://aip.scitation.org/doi/10.1063/1.480138 . ^ a b Zhen, Shu; Davies, G. J. (1983-08-16). “Calculation of the Lennard-Jonesn–m potential energy parameters for metals” (ドイツ語). Physica Status Solidi A 78 (2): 595–605. Bibcode : 1983PSSAR..78..595Z . doi :10.1002/pssa.2210780226 . https://onlinelibrary.wiley.com/doi/abs/10.1002/pssa.2210780226 .
^ a b Halicioglu, T.; Pound, G. M. (1975-08-16). “Calculation of potential energy parameters form crystalline state properties” (英語). Physica Status Solidi A 30 (2): 619–623. Bibcode : 1975PSSAR..30..619H . doi :10.1002/pssa.2210300223 . https://onlinelibrary.wiley.com/doi/abs/10.1002/pssa.2210300223 .
^ Eggimann, Becky L.; Sunnarborg, Amara J.; Stern, Hudson D.; Bliss, Andrew P.; Siepmann, J. Ilja (2014-01-02). “An online parameter and property database for the TraPPE force field” (英語). Molecular Simulation 40 (1–3): 101–105. doi :10.1080/08927022.2013.842994 . ISSN 0892-7022 . https://www.tandfonline.com/doi/full/10.1080/08927022.2013.842994 . ^ Jorgensen, William L.; Maxwell, David S.; Tirado-Rives, Julian (January 1996). “Development and Testing of the OPLS All-Atom Force Field on Conformational Energetics and Properties of Organic Liquids” (英語). Journal of the American Chemical Society 118 (45): 11225–11236. doi :10.1021/ja9621760 . ISSN 0002-7863 . https://pubs.acs.org/doi/10.1021/ja9621760 . ^ Stephan, Simon; Horsch, Martin T.; Vrabec, Jadran; Hasse, Hans (2019-07-03). “MolMod – an open access database of force fields for molecular simulations of fluids” (英語). Molecular Simulation 45 (10): 806–814. arXiv :1904.05206 . doi :10.1080/08927022.2019.1601191 . ISSN 0892-7022 . https://www.tandfonline.com/doi/full/10.1080/08927022.2019.1601191 . ^ Mendelev, M. I.; Han, S.; Srolovitz, D. J.; Ackland, G. J.; Sun, D. Y.; Asta, M. (2003). “Development of new interatomic potentials appropriate for crystalline and liquid iron” (英語). Philosophical Magazine 83 (35): 3977–3994. Bibcode : 2003PMag...83.3977A . doi :10.1080/14786430310001613264 . ISSN 1478-6435 . https://www.tandfonline.com/doi/abs/10.1080/14786430310001613264 . ^ a b c Allen, Michael P.; Tildesley, Dominic J. (2017-11-23). “Computer Simulation of Liquids”. Oxford Scholarship Online . doi :10.1093/oso/9780198803195.001.0001 . ISBN 9780198803195 .
^ a b D. C. Rapaport (1 April 2004). The Art of Molecular Dynamics Simulation ISBN 978-0-521-82568-9 . https://books.google.com/books?id=iqDJ2hjqBMEC
^ a b Schappals, Michael; Mecklenfeld, Andreas; Kröger, Leif; Botan, Vitalie; Köster, Andreas; Stephan, Simon; García, Edder J.; Rutkai, Gabor et al. (2017-09-12). “Round Robin Study: Molecular Simulation of Thermodynamic Properties from Models with Internal Degrees of Freedom” (英語). Journal of Chemical Theory and Computation 13 (9): 4270–4280. doi :10.1021/acs.jctc.7b00489 . ISSN 1549-9618 . PMID 28738147 . https://pubs.acs.org/doi/10.1021/acs.jctc.7b00489 .
^ a b c d e f g h i j k l m n o p q r s Stephan, Simon; Thol, Monika; Vrabec, Jadran; Hasse, Hans (2019-10-28). “Thermophysical Properties of the Lennard-Jones Fluid: Database and Data Assessment” (英語). Journal of Chemical Information and Modeling 59 (10): 4248–4265. doi :10.1021/acs.jcim.9b00620 . ISSN 1549-9596 . PMID 31609113 . https://pubs.acs.org/doi/10.1021/acs.jcim.9b00620 .
^ Loeffler, Hannes H.; Bosisio, Stefano; Duarte Ramos Matos, Guilherme; Suh, Donghyuk; Roux, Benoit; Mobley, David L.; Michel, Julien (2018-11-13). “Reproducibility of Free Energy Calculations across Different Molecular Simulation Software Packages” (英語). Journal of Chemical Theory and Computation 14 (11): 5567–5582. doi :10.1021/acs.jctc.8b00544 . hdl :20.500.11820/52d85d71-d3df-468b-8f88-9c52e83da1f1 ISSN 1549-9618 . PMID 30289712 . https://pubs.acs.org/doi/10.1021/acs.jctc.8b00544 . ^ a b Lenhard, Johannes; Küster, Uwe (2019). “Reproducibility and the Concept of Numerical Solution” (英語). Minds and Machines 29 (1): 19–36. doi :10.1007/s11023-019-09492-9 . ISSN 0924-6495 . https://link.springer.com/article/10.1007/s11023-019-09492-9 .
^ a b Hill, Terrell L. (1956). Statistical mechanics: principles and selected applications ISBN 0-486-65390-0 . OCLC 15163657 . https://www.worldcat.org/oclc/15163657
^ Shi, Wei; Johnson, J. Karl (2001-09-15). “Histogram reweighting and finite-size scaling study of the Lennard–Jones fluids” (英語). Fluid Phase Equilibria 187-188 : 171–191. doi :10.1016/S0378-3812(01)00534-9 . ISSN 0378-3812 . https://www.sciencedirect.com/science/article/abs/pii/S0378381201005349 . ^ Smit, B. (1992), “Phase diagrams of Lennard-Jones fluids” , Journal of Chemical Physics 96 (11): 8639–8640, Bibcode : 1992JChPh..96.8639S , doi :10.1063/1.462271 , https://pure.uva.nl/ws/files/2199981/29999_3595309057smi922.pdf ^ a b Metropolis, Nicholas; Rosenbluth, Arianna W.; Rosenbluth, Marshall N.; Teller, Augusta H.; Teller, Edward (1953). “Equation of State Calculations by Fast Computing Machines” (英語). The Journal of Chemical Physics 21 (6): 1087–1092. Bibcode : 1953JChPh..21.1087M . doi :10.1063/1.1699114 . ISSN 0021-9606 . OSTI 4390578 . https://aip.scitation.org/doi/10.1063/1.1699114 .
^ Rosenbluth, Marshall N.; Rosenbluth, Arianna W. (1954). “Further Results on Monte Carlo Equations of State” (英語). The Journal of Chemical Physics 22 (5): 881–884. Bibcode : 1954JChPh..22..881R . doi :10.1063/1.1740207 . ISSN 0021-9606 . https://aip.scitation.org/doi/10.1063/1.1740207 . ^ Wood, W. W.; Parker, F. R. (1957). “Monte Carlo Equation of State of Molecules Interacting with the Lennard‐Jones Potential. I. A Supercritical Isotherm at about Twice the Critical Temperature” (英語). The Journal of Chemical Physics 27 (3): 720–733. Bibcode : 1957JChPh..27..720W . doi :10.1063/1.1743822 . ISSN 0021-9606 . https://aip.scitation.org/doi/10.1063/1.1743822 . ^ Stephan, Simon; Thol, Monika; Vrabec, Jadran; Hasse, Hans (2019-10-28). “Thermophysical Properties of the Lennard-Jones Fluid: Database and Data Assessment” (英語). Journal of Chemical Information and Modeling 59 (10): 4248–4265. doi :10.1021/acs.jcim.9b00620 . ISSN 1549-9596 . PMID 31609113 . https://pubs.acs.org/doi/10.1021/acs.jcim.9b00620 . ^ a b c d e f g h Schultz, Andrew J.; Kofke, David A. (2018-11-28). “Comprehensive high-precision high-accuracy equation of state and coexistence properties for classical Lennard-Jones crystals and low-temperature fluid phases” . The Journal of Chemical Physics 149 (20): 204508. Bibcode : 2018JChPh.149t4508S . doi :10.1063/1.5053714 . ISSN 0021-9606 . PMID 30501268 . https://aip.scitation.org/doi/10.1063/1.5053714 .
^ a b c d e f g h Stephan, Simon; Staubach, Jens; Hasse, Hans (2020). “Review and comparison of equations of state for the Lennard-Jones fluid” (英語). Fluid Phase Equilibria 523 : 112772. doi :10.1016/j.fluid.2020.112772 . https://www.researchgate.net/publication/343378915 .
^ a b Schultz, Andrew J.; Kofke, David A. (2020-08-07). “Erratum: "Comprehensive high-precision high-accuracy equation of state and coexistence properties for classical Lennard-Jones crystals and low-temperature fluid phases" [J. Chem. Phys. 149, 204508 (2018)]” (英語). The Journal of Chemical Physics 153 (5): 059901. Bibcode : 2020JChPh.153e9901S . doi :10.1063/5.0021283 . ISSN 0021-9606 . PMID 32770918 .
^ a b Köster, Andreas; Mausbach, Peter; Vrabec, Jadran (2017-10-10). “Premelting, solid–fluid equilibria, and thermodynamic properties in the high density region based on the Lennard-Jones potential” . The Journal of Chemical Physics 147 (14): 144502. Bibcode : 2017JChPh.147n4502K . doi :10.1063/1.4990667 . ISSN 0021-9606 . PMID 29031254 . https://aip.scitation.org/doi/10.1063/1.4990667 .
^ a b c d e f g h i Stephan, Simon; Deiters, Ulrich K. (2020-08-20). “Characteristic Curves of the Lennard-Jones Fluid” (英語). International Journal of Thermophysics 41 (10): 147. Bibcode : 2020IJT....41..147S . doi :10.1007/s10765-020-02721-9 . ISSN 1572-9567 . PMC 7441092 . PMID 32863513 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7441092/ .
^ a b Deiters, Ulrich K.; Neumaier, Arnold (2016-08-11). “Computer Simulation of the Characteristic Curves of Pure Fluids” (英語). Journal of Chemical & Engineering Data 61 (8): 2720–2728. doi :10.1021/acs.jced.6b00133 . ISSN 0021-9568 . https://pubs.acs.org/doi/10.1021/acs.jced.6b00133 .
^ a b Agrawal, Rupal; Kofke, David A. (1995). “Thermodynamic and structural properties of model systems at solid–fluid coexistence: II. Melting and sublimation of the Lennard-Jones system” (英語). Molecular Physics 85 (1): 43–59. doi :10.1080/00268979500100921 . ISSN 0026-8976 . https://www.tandfonline.com/doi/abs/10.1080/00268979500100921 .
^ Brown, E.H. (1960). “On the thermodynamic properties of fluids”. Bulletin de l'Institut International du Froid Annexe 1960-1 : 169–178. ^ Apfelbaum, E. M.; Vorob’ev, V. S. (2020-06-18). “The Line of the Unit Compressibility Factor (Zeno-Line) for Crystal States” (英語). The Journal of Physical Chemistry B 124 (24): 5021–5027. doi :10.1021/acs.jpcb.0c02749 . ISSN 1520-6106 . PMID 32437611 . https://pubs.acs.org/doi/10.1021/acs.jpcb.0c02749 . ^ Apfelbaum, E. M.; Vorob’ev, V. S.; Martynov, G. A. (2008). “Regarding the Theory of the Zeno Line” (英語). The Journal of Physical Chemistry A 112 (26): 6042–6044. Bibcode : 2008JPCA..112.6042A . doi :10.1021/jp802999z . ISSN 1089-5639 . PMID 18543889 . https://pubs.acs.org/doi/10.1021/jp802999z . ^ a b c d Stephan, Simon; Hasse, Hans (2020-06-01). “Influence of dispersive long-range interactions on properties of vapour–liquid equilibria and interfaces of binary Lennard-Jones mixtures” (英語). Molecular Physics 118 (9–10): e1699185. Bibcode : 2020MolPh.11899185S . doi :10.1080/00268976.2019.1699185 . ISSN 0026-8976 . https://www.tandfonline.com/doi/full/10.1080/00268976.2019.1699185 .
^ Nicolas, J.J.; Gubbins, K.E.; Streett, W.B.; Tildesley, D.J. (1979). “Equation of state for the Lennard-Jones fluid” (英語). Molecular Physics 37 (5): 1429–1454. Bibcode : 1979MolPh..37.1429N . doi :10.1080/00268977900101051 . ISSN 0026-8976 . https://www.tandfonline.com/doi/full/10.1080/00268977900101051 . ^ Feng, Chao; Schultz, Andrew J.; Chaudhary, Vipin; Kofke, David A. (2015-07-28). “Eighth to sixteenth virial coefficients of the Lennard-Jones model” (英語). The Journal of Chemical Physics 143 (4): 044504. Bibcode : 2015JChPh.143d4504F . doi :10.1063/1.4927339 . ISSN 0021-9606 . PMID 26233142 . https://aip.scitation.org/doi/10.1063/1.4927339 . ^ Schultz, Andrew J.; Kofke, David A. (2009-11-10). “Sixth, seventh and eighth virial coefficients of the Lennard-Jones model” (英語). Molecular Physics 107 (21): 2309–2318. Bibcode : 2009MolPh.107.2309S . doi :10.1080/00268970903267053 . ISSN 0026-8976 . https://www.tandfonline.com/doi/abs/10.1080/00268970903267053 . ^ Bell, Ian H.; Messerly, Richard; Thol, Monika; Costigliola, Lorenzo; Dyre, Jeppe C. (2019-07-25). “Modified Entropy Scaling of the Transport Properties of the Lennard-Jones Fluid” (英語). The Journal of Physical Chemistry B 123 (29): 6345–6363. doi :10.1021/acs.jpcb.9b05808 . ISSN 1520-6106 . PMC 7147083 . PMID 31241958 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7147083/ . ^ Lautenschlaeger, Martin P.; Hasse, Hans (2019). “Transport properties of the Lennard-Jones truncated and shifted fluid from non-equilibrium molecular dynamics simulations” (英語). Fluid Phase Equilibria 482 : 38–47. doi :10.1016/j.fluid.2018.10.019 . https://osf.io/67w4u/ . ^ a b c Travesset, Alex (2014-10-28). “Phase diagram of power law and Lennard-Jones systems: Crystal phases” (英語). The Journal of Chemical Physics 141 (16): 164501. Bibcode : 2014JChPh.141p4501T . doi :10.1063/1.4898371 . ISSN 0021-9606 . PMID 25362319 . https://aip.scitation.org/doi/10.1063/1.4898371 .
^ Hansen, Jean-Pierre; Verlet, Loup (1969-08-05). “Phase Transitions of the Lennard-Jones System” (英語). Physical Review 184 (1): 151–161. Bibcode : 1969PhRv..184..151H . doi :10.1103/PhysRev.184.151 . ISSN 0031-899X . https://journals.aps.org/pr/abstract/10.1103/PhysRev.184.151 . ^ Longuet-Higgins, H.C. (1951-02-07). “The statistical thermodynamics of multicomponent systems” (英語). Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences 205 (1081): 247–269. Bibcode : 1951RSPSA.205..247L . doi :10.1098/rspa.1951.0028 . ISSN 0080-4630 . https://royalsocietypublishing.org/doi/10.1098/rspa.1951.0028 . ^ Leland, T. W.; Rowlinson, J. S.; Sather, G. A. (1968). “Statistical thermodynamics of mixtures of molecules of different sizes” (英語). Transactions of the Faraday Society 64 : 1447. doi :10.1039/tf9686401447 . ISSN 0014-7672 . https://pubs.rsc.org/en/content/articlelanding/1968/TF/tf9686401447 . ^ Mansoori, G. Ali; Leland, Thomas W. (1972). “Statistical thermodynamics of mixtures. A new version for the theory of conformal solution” (英語). Journal of the Chemical Society, Faraday Transactions 2 68 : 320. doi :10.1039/f29726800320 . ISSN 0300-9238 . https://pubs.rsc.org/en/content/articlelanding/1972/F2/f29726800320 . ^ Rowlinson, J.S.; Swinton, F.L. (1982). Liquids and liquid mixtures (Third ed.). London: Butterworth ^ a b Deiters, Ulrich K.; Kraska, Thomas (2012). High-pressure fluid phase equilibria: phenomenology and computation ISBN 978-0-444-56354-5 . OCLC 787847134 . https://www.worldcat.org/oclc/787847134
^ Schnabel, Thorsten; Vrabec, Jadran; Hasse, Hans (2007). “Unlike Lennard–Jones parameters for vapor–liquid equilibria” (英語). Journal of Molecular Liquids 135 (1–3): 170–178. arXiv :0904.4436 . doi :10.1016/j.molliq.2006.12.024 . ^ Lorentz, H. A. (1881). “Ueber die Anwendung des Satzes vom Virial in der kinetischen Theorie der Gase” (ドイツ語). Annalen der Physik 248 (1): 127–136. Bibcode : 1881AnP...248..127L . doi :10.1002/andp.18812480110 . https://onlinelibrary.wiley.com/doi/abs/10.1002/andp.18812480110 . ^ van Konynenburg, P.H.; Scott, R.L. (1980-12-18). “Critical lines and phase equilibria in binary van der Waals mixtures” (英語). Philosophical Transactions of the Royal Society of London. Series A, Mathematical and Physical Sciences 298 (1442): 495–540. Bibcode : 1980RSPTA.298..495K . doi :10.1098/rsta.1980.0266 . ISSN 0080-4614 . https://royalsocietypublishing.org/doi/10.1098/rsta.1980.0266 . ^ Potoff, Jeffrey J.; Panagiotopoulos, Athanassios Z. (1998-12-22). “Critical point and phase behavior of the pure fluid and a Lennard-Jones mixture” (英語). The Journal of Chemical Physics 109 (24): 10914–10920. Bibcode : 1998JChPh.10910914P . doi :10.1063/1.477787 . ISSN 0021-9606 . https://aip.scitation.org/doi/10.1063/1.477787 . ^ Protsenko, Sergey P.; Baidakov, Vladimir G. (2016). “Binary Lennard-Jones mixtures with highly asymmetric interactions of the components. 1. Effect of the energy parameters on phase equilibria and properties of liquid–gas interfaces” (英語). Fluid Phase Equilibria 429 : 242–253. doi :10.1016/j.fluid.2016.09.009 . ^ Protsenko, Sergey P.; Baidakov, Vladimir G.; Bryukhanov, Vasiliy M. (2016). “Binary Lennard-Jones mixtures with highly asymmetric interactions of the components. 2. Effect of the particle size on phase equilibria and properties of liquid–gas interfaces” (英語). Fluid Phase Equilibria 430 : 67–74. doi :10.1016/j.fluid.2016.09.022 . ^ Stephan, Simon; Hasse, Hans (2020-01-23). “Molecular interactions at vapor–liquid interfaces: Binary mixtures of simple fluids” (英語). Physical Review E 101 (1): 012802. Bibcode : 2020PhRvE.101a2802S . doi :10.1103/PhysRevE.101.012802 . ISSN 2470-0045 . PMID 32069593 . https://journals.aps.org/pre/abstract/10.1103/PhysRevE.101.012802 . ^ a b Lamm, Monica H.; Hall, Carol K. (2002). “Equilibria between solid, liquid, and vapor phases in binary Lennard–Jones mixtures” (英語). Fluid Phase Equilibria 194-197 : 197–206. doi :10.1016/S0378-3812(01)00650-1 .
^ a b Lamm, Monica H.; Hall, Carol K. (2001). “Monte Carlo simulations of complete phase diagrams for binary Lennard–Jones mixtures” (英語). Fluid Phase Equilibria 182 (1–2): 37–46. doi :10.1016/S0378-3812(01)00378-8 .
^ a b Hitchcock, Monica R.; Hall, Carol K. (1999-06-15). “Solid–liquid phase equilibrium for binary Lennard-Jones mixtures” (英語). The Journal of Chemical Physics 110 (23): 11433–11444. Bibcode : 1999JChPh.11011433H . doi :10.1063/1.479084 . ISSN 0021-9606 . https://aip.scitation.org/doi/10.1063/1.479084 .
^ Jungblut, Swetlana; Dellago, Christoph (2011-03-14). “Crystallization of a binary Lennard-Jones mixture” (英語). The Journal of Chemical Physics 134 (10): 104501. Bibcode : 2011JChPh.134j4501J . doi :10.1063/1.3556664 . ISSN 0021-9606 . PMID 21405169 . https://aip.scitation.org/doi/10.1063/1.3556664 . ^ a b Lamm, Monica H.; Hall, Carol K. (2004). “Effect of pressure on the complete phase behavior of binary mixtures” (英語). AIChE Journal 50 (1): 215–225. doi :10.1002/aic.10020 . ISSN 0001-1541 .
^ Mecke, M.; Müller, A.; Winkelmann, J.; Vrabec, J.; Fischer, J.; Span, R.; Wagner, W. (1996-03-01). “An accurate Van der Waals-type equation of state for the Lennard-Jones fluid” (英語). International Journal of Thermophysics 17 (2): 391–404. Bibcode : 1996IJT....17..391M . doi :10.1007/BF01443399 . ISSN 1572-9567 . https://link.springer.com/article/10.1007/BF01443399 . ^ a b c d e Kolafa, Jiří; Nezbeda, Ivo (1994). “The Lennard-Jones fluid: an accurate analytic and theoretically-based equation of state” (英語). Fluid Phase Equilibria 100 : 1–34. doi :10.1016/0378-3812(94)80001-4 .
^ Thol, Monika; Rutkai, Gabor; Köster, Andreas; Lustig, Rolf; Span, Roland; Vrabec, Jadran (2016). “Equation of State for the Lennard-Jones Fluid” (英語). Journal of Physical and Chemical Reference Data 45 (2): 023101. Bibcode : 2016JPCRD..45b3101T . doi :10.1063/1.4945000 . ISSN 0047-2689 . https://aip.scitation.org/doi/10.1063/1.4945000 . ^ Gottschalk, Matthias (2019-12-01). “An EOS for the Lennard-Jones fluid: A virial expansion approach” (英語). AIP Advances 9 (12): 125206. Bibcode : 2019AIPA....9l5206G . doi :10.1063/1.5119761 . ISSN 2158-3226 . ^ a b Johnson, J. Karl; Zollweg, John A.; Gubbins, Keith E. (1993-02-20). “The Lennard-Jones equation of state revisited” (英語). Molecular Physics 78 (3): 591–618. Bibcode : 1993MolPh..78..591J . doi :10.1080/00268979300100411 . ISSN 0026-8976 . https://www.tandfonline.com/doi/abs/10.1080/00268979300100411 .
^ Frenkel, D.; Smit, B. (2002), Understanding Molecular Simulation (Second ed.), San Diego: Academic Press, ISBN 0-12-267351-4 ^ Vrabec, Jadran; Kedia, Gaurav Kumar; Fuchs, Guido; Hasse, Hans (2006-05-10). “Comprehensive study of the vapour–liquid coexistence of the truncated and shifted Lennard–Jones fluid including planar and spherical interface properties” (英語). Molecular Physics 104 (9): 1509–1527. Bibcode : 2006MolPh.104.1509V . doi :10.1080/00268970600556774 . ISSN 0026-8976 . https://www.tandfonline.com/doi/abs/10.1080/00268970600556774 . ^ Heier, Michaela; Stephan, Simon; Liu, Jinlu; Chapman, Walter G.; Hasse, Hans; Langenbach, Kai (2018-08-18). “Equation of state for the Lennard-Jones truncated and shifted fluid with a cut-off radius of 2.5 σ based on perturbation theory and its applications to interfacial thermodynamics” (英語). Molecular Physics 116 (15–16): 2083–2094. Bibcode : 2018MolPh.116.2083H . doi :10.1080/00268976.2018.1447153 . ISSN 0026-8976 . https://www.tandfonline.com/doi/full/10.1080/00268976.2018.1447153 . ^ Shaul, Katherine R. S.; Schultz, Andrew J.; Kofke, David A. (2010). “The effect of truncation and shift on virial coefficients of Lennard–Jones potentials” (英語). Collection of Czechoslovak Chemical Communications 75 (4): 447–462. doi :10.1135/cccc2009113 . ISSN 1212-6950 . http://cccc.uochb.cas.cz/75/4/0447/ . ^ Shi, Wei; Johnson, J.Karl (2001). “Histogram reweighting and finite-size scaling study of the Lennard–Jones fluids” (英語). Fluid Phase Equilibria 187-188 : 171–191. doi :10.1016/S0378-3812(01)00534-9 . ^ Dunikov, D. O.; Malyshenko, S. P.; Zhakhovskii, V. V. (2001-10-08). “Corresponding states law and molecular dynamics simulations of the Lennard-Jones fluid” (英語). The Journal of Chemical Physics 115 (14): 6623–6631. Bibcode : 2001JChPh.115.6623D . doi :10.1063/1.1396674 . ISSN 0021-9606 . https://aip.scitation.org/doi/10.1063/1.1396674 . ^ Lívia B. Pártay, Christoph Ortner, Albert P. Bartók, Chris J. Pickard, and Gábor Csányi "Polytypism in the ground state structure of the Lennard-Jonesium", Physical Chemistry Chemical Physics 19 19369 (2017) ^ Tchipev, Nikola; Seckler, Steffen; Heinen, Matthias; Vrabec, Jadran; Gratl, Fabio; Horsch, Martin; Bernreuther, Martin; Glass, Colin W et al. (2019). “TweTriS: Twenty trillion-atom simulation” (英語). The International Journal of High Performance Computing Applications 33 (5): 838–854. doi :10.1177/1094342018819741 . ISSN 1094-3420 . https://journals.sagepub.com/doi/10.1177/1094342018819741 . ^ Stephan, Simon; Liu, Jinlu; Langenbach, Kai; Chapman, Walter G.; Hasse, Hans (2018). “Vapor−Liquid Interface of the Lennard-Jones Truncated and Shifted Fluid: Comparison of Molecular Simulation, Density Gradient Theory, and Density Functional Theory” (英語). The Journal of Physical Chemistry C 122 (43): 24705–24715. doi :10.1021/acs.jpcc.8b06332 . ISSN 1932-7447 . https://pubs.acs.org/doi/10.1021/acs.jpcc.8b06332 . ^ Pedersen, Ulf R.; Schrøder, Thomas B.; Dyre, Jeppe C. (2018-04-20). “Phase Diagram of Kob-Andersen-Type Binary Lennard-Jones Mixtures” . Physical Review Letters 120 (16): 165501. arXiv :1803.08956 . Bibcode : 2018PhRvL.120p5501P . doi :10.1103/PhysRevLett.120.165501 . PMID 29756931 . https://journals.aps.org/prl/abstract/10.1103/PhysRevLett.120.165501 . ^ Kob, Walter; Andersen, Hans C. (1995-05-01). “Testing mode-coupling theory for a supercooled binary Lennard-Jones mixture I: The van Hove correlation function” . Physical Review E 51 (5): 4626–4641. arXiv :cond-mat/9501102 . Bibcode : 1995PhRvE..51.4626K . doi :10.1103/PhysRevE.51.4626 . PMID 9963176 . https://journals.aps.org/pre/abstract/10.1103/PhysRevE.51.4626 . ^ Stephan, Simon; Hasse, Hans (2020-06-01). “Influence of dispersive long-range interactions on properties of vapour–liquid equilibria and interfaces of binary Lennard-Jones mixtures” (英語). Molecular Physics 118 (9–10): e1699185. Bibcode : 2020MolPh.11899185S . doi :10.1080/00268976.2019.1699185 . ISSN 0026-8976 . https://www.tandfonline.com/doi/full/10.1080/00268976.2019.1699185 . ^ Smit, B. (1992), “Phase diagrams of Lennard-Jones fluids” , Journal of Chemical Physics 96 (11): 8639–8640, Bibcode : 1992JChPh..96.8639S , doi :10.1063/1.462271 , https://pure.uva.nl/ws/files/2199981/29999_3595309057smi922.pdf ^ Dunikov, D. O.; Malyshenko, S. P.; Zhakhovskii, V. V. (2001-10-08). “Corresponding states law and molecular dynamics simulations of the Lennard-Jones fluid” (英語). The Journal of Chemical Physics 115 (14): 6623–6631. Bibcode : 2001JChPh.115.6623D . doi :10.1063/1.1396674 . ISSN 0021-9606 . https://aip.scitation.org/doi/10.1063/1.1396674 . ^ Lafitte, Thomas; Apostolakou, Anastasia; Avendaño, Carlos; Galindo, Amparo; Adjiman, Claire S.; Müller, Erich A.; Jackson, George (2013-10-16). “Accurate statistical associating fluid theory for chain molecules formed from Mie segments” . The Journal of Chemical Physics 139 (15): 154504. Bibcode : 2013JChPh.139o4504L . doi :10.1063/1.4819786 . hdl :10044/1/12859 ISSN 0021-9606 . PMID 24160524 . https://aip.scitation.org/doi/10.1063/1.4819786 . ^ Grüneisen, Edward (1911). “Das Verhältnis der thermischen Ausdehnung zur spezifischen Wärme fester Elemente” . Zeitschrift für Elektrochemie und angewandte physikalische Chemie 17 (17): 737–739. doi :10.1002/bbpc.191100004 . https://onlinelibrary.wiley.com/doi/abs/10.1002/bbpc.191100004 . ^ Grüneisen, E. (1912). “Theorie des festen Zustandes einatomiger Elemente” (ドイツ語). Annalen der Physik 344 (12): 257–306. Bibcode : 1912AnP...344..257G . doi :10.1002/andp.19123441202 . https://onlinelibrary.wiley.com/doi/abs/10.1002/andp.19123441202 . ^ Mie, Gustav (1903). “Zur kinetischen Theorie der einatomigen Körper” (ドイツ語). Annalen der Physik 316 (8): 657–697. Bibcode : 1903AnP...316..657M . doi :10.1002/andp.19033160802 . https://onlinelibrary.wiley.com/doi/abs/10.1002/andp.19033160802 .




















![{\displaystyle U(r)=4\epsilon \left[\left({\frac {\sigma }{r}}\right)^{p}-\left({\frac {\sigma }{r}}\right)^{q}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c1037cb6dad1ac0e0f15659ad3769b6db76fc06)



![{\displaystyle U(r)=4\epsilon \left[\left({\frac {\sigma }{r}}\right)^{12}-\left({\frac {\sigma }{r}}\right)^{6}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e268f128d1844e0e29fccfaceeba0a7bb9d2f508)








![{\displaystyle U(r)=\epsilon \left[\left({\frac {r_{0}}{r}}\right)^{12}-2\left({\frac {r_{0}}{r}}\right)^{6}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/213db15aa911001ab844aa0e37fdd6c75d908b9f)


























































































![{\displaystyle V_{\text{LJ}}(r)=4\varepsilon \left[\left({\frac {\sigma }{r}}\right)^{12}-\left({\frac {\sigma }{r}}\right)^{6}\right],}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82d16f77cae964a5c4c52fb89165dd5d596ee03f)







