A naftolok a naftalin hidroxilcsoportot tartalmazó származékai, a fenolok közé tartoznak. Két izomer létezik ezek neve α-naftol (vagy 1-naftol) illetve β-naftol (vagy 2-naftol). Mindkettő színtelen kristályos vegyület, a β-naftol sárgás színű is lehet. Vízben rosszul, alkoholban, éterben jól oldódnak. A természetben a kőszénkátrányban fordulnak elő. Gyakorlati jelentőségük nagy, főként szerves színezékek gyártására használják őket.
Kémiai tulajdonságaik
A naftolok kémiai tulajdonságai hasonlítanak egymáshoz. Mindkettő savjellegű vegyület. Lúgokban oldódnak, só képződik. Oxidációval szemben érzékenyek. Vas(III)-klorid-oldat hatására színes csapadékot adnak, az α-naftol ibolya, a β-naftol zöld színűt. Szubsztitúciós reakciókra hajlamosak, a reakciókészségüket a gyűrűhöz kapcsolódó hidroxilcsoport növeli (aktiváló hatás).
Előfordulásuk
A természetben kis mennyiségben a kőszénkátrányban fordulnak elő.
Előállításuk
Az α-naftol az α-naftalinszulfonsav, a β-naftol a β-naftalinszulfonsav nátriumsójából állítható elő, nátrium-hidroxiddal végzett ömlesztés (alkáliömlesztés) útján.
Felhasználásuk
A naftolokat főként színezékek gyártására használják, de készülnek belőlük növényvédőszerek, például rovar- és gombairtószerek is.
A naftolok adatai
| Naftolok
|
| Név
|
1-Naftol |
2-Naftol
|
| Más nevek
|
α-Naftol,
1-Hidroxinaftalin |
β-Naftol,
2-Hidroxinaftalin
|
| Szerkezeti képlet
|
![]() |
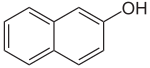
|
| Háromdimenziós modell
|
 |
|
| CAS-szám
|
90-15-3 |
205-182-7
|
| PubChem
|
7005 |
8663
|
| Összegképlet
|
C10H8O
|
| Moláris tömeg
|
144,17 g·mol−1
|
| Halmazállapot
|
szilárd
|
| Megjelenés
|
színtelen,
enyhén fenolszagú kristályok |
fehér vagy sárgás színű,
fenolra emlékeztető szagú kristályok
|
| Olvadáspont
|
95–97 °C[1]
|
123 °C[2]
|
| Forráspont
|
288 °C[1] |
285 °C[2]
|
| Oldhatóság (vízben)
|
Gyakorlatilag oldhatatlan (0,1 g/l)
|
EU osztályozás
[1][2]
|
Ártalmas (Xn)
|
Ártalmas (Xn),
Veszélyes a környezetre (N)
|
| R-mondatok
|
R21/22, R37/38, R41[1]
|
R20/22 R50[2]
|
| S-mondatok
|
(S2), S22, S26, S37/39[1]
|
(S2), S24/25, S61[2]
|
| LD50 (patkány, szájon át)
|
1870 mg/kg[1]
|
1960 mg/kg[2]
|
Források
- Bruckner Győző: Szerves kémia, II/1-es kötet
- Erdey-Grúz Tibor: Vegyszerismeret
Hivatkozások
Lásd még