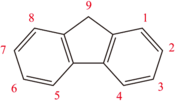
Fluorène
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

Halaman ini berisi artikel tentang the album. Untuk its title track, lihat Thank U, Next (lagu). Thank U, NextSampul album[1][2]Album studio karya Ariana GrandeDirilis8 Februari 2019 (2019-02-08)DirekamOktober–Desember 2018[3][4]GenrePopR&BtrapDurasi41:11LabelRepublicProduser Charles Anderson Brian Baptiste Tommy Brown Michael Foster Ilya Max Martin Happy Perez Pop Wansel Kronologi Ariana Grande Sweetener(2018) Thank U, Next(2019) Positions(2020)...

Bupati LuwuPetahanaMuhammad SalehPenjabatsejak 21 Februari 2024KediamanRumah Jabatan Bupati LuwuMasa jabatan5 tahunDibentuk1940Pejabat pertamaAndi Kaso Berikut ini adalah daftar bupati Luwu yang menjabat sejak pembentukannya pada tahun 1940. No Potret Bupati Mulai menjabat Akhir menjabat Partai Wakil Bupati Periode Ref. 1 Andi Kaso 1940 1949 N/A 1 2 Pakki Daeng Masiga 1949 1951 N/A 2 3 Abdul Majid Pattaropura 1952 1954 N/A 3 4 Inje Naim 1954 1956 N/A 4 5 La Ki...

2012 2022 Élections législatives de 2017 dans la Haute-Vienne 3 sièges de députés à l'Assemblée nationale 11 et 18 juin 2017 Type d’élection Élections législatives Campagne 22 mai au 10 juin12 juin au 16 juin Corps électoral et résultats Inscrits 265 251 Votants au 1er tour 148 987 56,17 % 6,1 Votes exprimés au 1er tour 144 534 Votes blancs au 1er tour 2 692 Votes nuls au 1er tour 1 761 Votants au 2d tour 130 701 5...

Administrator in charge of large districts in Christian denominations A diocesan bishop, within various Christian traditions, is a bishop or archbishop in pastoral charge of a diocese or archdiocese. In relation to other bishops, a diocesan bishop may be a suffragan, a metropolitan (if an archbishop) or a primate. They may also hold various other positions such as being a cardinal or patriarch. Titular bishops in the Roman Catholic Church may be assistant bishops with special faculties, coadj...

Andrea Conti Informasi pribadiNama lengkap Andrea ContiTanggal lahir 2 Maret 1994 (umur 30)Tempat lahir Lecco, ItaliaTinggi 1,84 m (6 ft 1⁄2 in)Posisi bermain Bek kananInformasi klubKlub saat ini AC MilanNomor 12Karier junior2003–2013[1] AtalantaKarier senior*Tahun Tim Tampil (Gol)2013–2017 Atalanta 47 (10)2013–2014 → Perugia (pinjaman) 16 (0)2014–2015 → Virtus Lanciano (pinjaman) 24 (0)2017– AC Milan 2 (0)Tim nasional‡2010–2011 Italia U-17...

Pour les articles homonymes, voir Aile. Pour un article plus général, voir Configuration d'aile. Le nEUROn de Dassault Aviation. Le Northrop B-2 Spirit, avion bombardier emblématique des ailes volantes. Une aile volante désigne un aéronef ne possédant ni fuselage, ni empennage, et dont l’ensemble des différentes surfaces mobiles nécessaires à son pilotage est situé sur la voilure. Par conséquent, le cockpit est intégré à l’aile qui embarque également la charge utile (passa...

American financial advisor (born 1951) Suze OrmanOrman in 2010Born (1951-06-05) June 5, 1951 (age 72)Chicago, Illinois, U.S.EducationUniversity of Illinois at Urbana–Champaign (BA)OccupationsFinancial advisorauthorpodcasterKnown forThe Suze Orman ShowSpouse Kathy Travis (m. 2010)WebsiteOfficial websiteSignature Susan Lynn Suze Orman (/ˈsuːzi/ SOO-zee; born June 5, 1951) is an American financial advisor, author, and podcast host. In 1987, she founde...

The Legend of Zelda: A Link to the PastvideogiocoConfezione originale del videogiocoTitolo originaleゼルダの伝説 神々のトライフォース PiattaformaSuper Nintendo, Game Boy Advance Data di pubblicazioneSuper Nintendo: 21 novembre 1991 13 aprile 1992 24 settembre 1992 Game Boy Advance: 14 marzo 2003 2 dicembre 2002 28 marzo 2003 Virtual Console (Wii): 2 dicembre 2006 22 gennaio 2007 23 marzo 2007 23 marzo 2007 Virtual Console (Wii U): 12 febbraio 2014 30 gennaio 2014 12 dicemb...

South Korean politician In this Korean name, the family name is Hwang. The HonourableHwang Woo-yea황우여Deputy Prime Minister of South KoreaIn office19 November 2014 – 12 January 2016Serving with Choi Kyoung-hwanPresidentPark Geun-hye Hwang Kyo-ahn (Acting)Prime MinisterChung Hong-won Lee Wan-koo Choi Kyoung-hwan (Acting) Hwang Kyo-ahnPreceded bySeo Nam-seeSucceeded byLee Joon-sikMinister of EducationIn office8 August 2014 – 12 January 2016Preceded bySeo Nam-s...

Watson governmentIn office27 April 1904 – 18 August 1904MonarchEdward VIIPrime MinisterChris WatsonPartyLaborStatusMinority (Protectionist support)OriginPredecessor lost confidence motionDemiseLost confidence motionPredecessorDeakin government (I)SuccessorReid government The Watson government was the third federal executive government of the Commonwealth of Australia. It was led by Prime Minister Chris Watson of the Australian Labor Party from 27 April 1904 to 18 August 1904. The Wats...

Mocetinostat Names Preferred IUPAC name N-(2-Aminophenyl)-4-({[4-(pyridin-3-yl)pyrimidin-2-yl]amino}methyl)benzamide Identifiers CAS Number 726169-73-9 Y 3D model (JSmol) Interactive image ChEBI CHEBI:197437 ChEMBL ChEMBL272980 N ChemSpider 8041206 N IUPHAR/BPS 7008 KEGG D09641 PubChem CID 9865515 UNII A6GWB8T96J Y CompTox Dashboard (EPA) DTXSID80222945 InChI InChI=1S/C23H20N6O/c24-19-5-1-2-6-21(19)28-22(30)17-9-7-16(8-10-17)14-27-23-26-13-11-20(29-23)18-4-3-12-25-15-18/h...

Joachim Gauck Joachim Gauck en 2012. Fonctions Président fédéral d'Allemagne 18 mars 2012 – 18 mars 2017(5 ans) Élection 18 mars 2012 Chancelier Angela Merkel Prédécesseur Horst Seehofer (intérim)Christian Wulff Successeur Frank-Walter Steinmeier Commissaire fédéral pour la documentation du Service de sécurité de l'État de l'ex-République démocratique allemande 4 octobre 1990 – 11 octobre 2000(10 ans et 7 jours) Président fédéral Richard von WeizsäckerRom...

Друга англо-бурська війна Англо-бурські війни Бурські вояки біля Спайон Коп. 1900Бурські вояки біля Спайон Коп. 1900 Дата: 11 жовтня 1899 — 31 травня 1902 Місце: Південна Африка Результат: Перемога Британської імперії Сторони Велика Британія: Австралія Індія Нова Зеландія Канада Р...

First edition(publ. New American Library) Red-Dirt Marijuana and Other Tastes (ISBN 0-8065-1167-2) is a collection of short fiction and essays works by satirical novelist and screenwriter Terry Southern, which was first published in 1967. It consists of twenty-four pieces which were originally published in Esquire magazine, Evergreen Review, Harper's Bazaar, Hasty Papers, Nugget, The Paris Review, and The Realist. It was re-published in 1990 with a new introduction by George Plimpton. A ...

Tanzania is an active and prominent member state of the Non-Aligned Movement since the days of independence of Tanganyika in 1961.[1] In early days of the movement President Julius Nyerere was recognized as one of the leading figures in the movement and among Third World leaders in general.[2][3] His government promoted close adherence to non-alignment principles in which Global North and Global South division was more important than Cold War East–West dichotomy, su...

This is a list of properties and districts listed on the National Register of Historic Places in Alaska. There are approximately 400 listed sites in Alaska. Each of the state's 30 boroughs and census areas has at least two listings on the National Register, except for the Kusilvak Census Area, which has none. Contents: Boroughs and census areas in AlaskaBorough names are highlighted in bold Aleutians East • Aleutians West • Anchorage • Bethel • Bristol Bay • Chugach • Copper Rive...

بنت النيلمعلومات عامةالصنف الفني دراماتاريخ الصدور25 أبريل 1929 (1929-04-25)اللغة الأصلية صامتالعرض سينما أميريكان كوزمو جراف بالقاهرة لمدة أسبوع واحد فقطمأخوذ عن مسرحية (إحسان بك)البلد المملكة المصريةالطاقمالمخرج روكاعمر وصفيالكاتب محمد عبد القدوسالقصة عزيزة أمير...

Placement of a tube into the trachea Tracheal intubationAnesthesiologist using the Glidescope video laryngoscope to intubate the trachea of a morbidly obese elderly person with challenging airway anatomyICD-9-CM96.04MeSHD007442OPS-301 code8-701MedlinePlus003449[edit on Wikidata] Tracheal intubation, usually simply referred to as intubation, is the placement of a flexible plastic tube into the trachea (windpipe) to maintain an open airway or to serve as a conduit through which to admi...

Cet article est une ébauche concernant l’astronomie. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants. L'éruption solaire de 774-775 est une éruption solaire majeure, considérée comme la plus importante avec celle de 660 av. J.-C.[1],[2]. Elle donne lieu au pic de carbone 14 de 774-775. Notes et références ↑ (en) Paschal O’Hare, Florian Mekhaldi, Florian Adolphi, Grant Raisbeck, Ala Aldahan, Emma ...

Banco Hipotecario S.A.Banco Hipotecario headquarters building in Buenos AiresCompany typeSociedad AnónimaTraded asBCBA:BHIPIndustryFinancial servicesFounded1886; 138 years ago (1886)HeadquartersBuenos Aires, ArgentinaKey peopleEduardo Elsztain, (Chairman) Mario Blejer, (Vice president)ProductsRetail bankingMortgagesConsumer financeCredit cardsRevenue US$ 330 million (2011)[1]Net income US$ 56 million (2011)[1]Total assets US$ 2.84 billion (2011)[2]Nu...