Acénaphtylène
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

Patung dan altar Hung Shing pada Kuil Hung Shing di Hang Mei Tsuen, Ping Shan, Hong Kong. Hong Sheng (Hanzi=洪聖; pinyin=Hóng shèng;Kantonis=Hung Shing), juga dipanggil dengan nama Hong Sheng Ye (洪聖爺; Hóng shèng yé; Hung Shing Ye) dan Da Wang (大王; dàwáng; Tai Wong), merupakan seorang pejabat pemerintahan pada masa Dinasti Tang (618-907 Masehi)[1][2] yang bernama Hong Xi (洪熙; Hóng Xī; Hung Hei). Ia bertugas di Pun Yue yang kini disebut dengan nama Guang...

Giovanni da Pian del CarpineBiografiKelahiran1182 Magione Kematian1r Agustus 1252 (69/70 tahun)Bar Archbishop of Bar (en) 1248 – – Geoffroy of Bar (en) → Keuskupan: Keuskupan Agung Bar Data pribadiAgamaGereja Katolik Roma KegiatanPekerjaanExplorer (en), imam Katolik, diplomat, sejarawan, penulis dan Misionaris Murid dariFransiskus dari Assisi Ordo keagamaanFransiskan dan Ordo Fratrum Minorum KonsekrasiPaus Inosensius IV Karya kreatifKarya terkenal Ystoria ...

DerangedPoster promosiNama lainHangul연가시 Hanja鐵線蟲 Alih Aksara yang DisempurnakanYeongasiMcCune–ReischauerYŏn’gasi SutradaraPark Jung-wooProduserLim Ji-youngDitulis olehPark Jung-wooJo Dong-inKim Kyeong-hoonPemeranKim Myung-minKim Dong-wanMoon Jung-heeLee Ha-nuiPenata musikJo Yeong-wookSinematograferGi Se-hunPenyuntingPark Gok-jiPerusahaanproduksiOz One FilmDistributorCJ E&MTanggal rilis 05 Juli 2012 (2012-07-05) Durasi109 menitNegaraKorea SelatanBahasaKor...

لمعانٍ أخرى، طالع الحرية (توضيح). الحريةLiberté (بالفرنسية) معلومات عامةالتقسيم الإداري شارنتون لو بونت البلد فرنسا شبكة المواصلات مترو باريس المالك الهيئة المستقلة للنقل في باريس الإدارة الهيئة المستقلة للنقل في باريس الخطوط الخط 8 لمترو باريس المحطات المجاورة بو�...

Aksara regulerJenis aksara Logogram BahasaTionghoa Kuno, Tionghoa Pertengahan, Tionghoa ModernPeriodeTiongkok Zaman Perunggu, Tiongkok Zaman Besi, saat sekarangAksara terkaitSilsilahAksara tulang ramalanAksara perungguAksara segelAksara rohaniwanAksara regulerAksara turunanKanjiKanaHanjaZhuyinTionghoa SederhanaChu NomAksara KhitanAksara JurchenAksara TangutNü ShuPengkodean UnicodeRentang Unicode4E00–9FFF, 3400–4DBF, 20000–2A6DF, 2A700–2B734, 2F00–2FDF, F900–FAFF Artikel ini ...

Rodrigo De Paul De Paul pada 2019Informasi pribadiNama lengkap Rodrigo Javier De Paul[1]Tanggal lahir 24 Mei 1994 (umur 29)Tempat lahir Sarandí, ArgentinaTinggi 175 cm (5 ft 9 in)[2]Posisi bermain GelandangInformasi klubKlub saat ini Atletico MadridNomor 5Karier junior2002–2012 Racing ClubKarier senior*Tahun Tim Tampil (Gol)2012–2014 Racing Club 54 (6)2014–2016 Valencia 34 (1)2016 → Racing Club (pinjaman) 11 (0)2016–2021 Udinese 177 (93)2021– ...

Salah satu pintu masuk dari kamar mayat umum Victoria, di Hong Kong Loker tempat penyimpanan mayat Seorang dokter sedang memeriksa jenazah-jenazah korban pertempuran Alcatraz di San Fransisco. Kamar mayat (di rumah sakit atau di tempat lain) digunakan untuk penyimpanan mayat manusia menunggu identifikasi, atau pemindahan untuk otopsi atau pelepasan dengan penguburan, kremasi atau sebaliknya. Di zaman modern kamar mayat yang telah berpendingin lazim digunakan untuk menunda dekomposisi. Jenis k...

2009 single by ArashiMy GirlCD coverSingle by Arashifrom the album Boku no Miteiru Fūkei B-sideTokei Jikake no UmbrellaSuper FreshReleasedNovember 11, 2009 (2009-11-11)Recorded2009GenrePopLabelJ StormSongwriter(s)WonderlandArashi singles chronology Everything (2009) My Girl (2009) Troublemaker (2010) My Girl (マイガール, Mai Gāru) is a song recorded by Japanese boy band Arashi. It was released on November 11, 2009 through their record label J Storm. My Girl was used as t...

American lawyer and politician Denise M. DuchenyMember of the Board of Directors of the Border Environment Cooperation CommissionIncumbentAssumed office 2014Appointed byBarack ObamaMember of the Board of Directors of the North American Development BankIncumbentAssumed office 2014Appointed byBarack ObamaMember of the California Unemployment Insurance Appeals BoardIn officeJanuary 2011 – September 2011[1]Member of the California Senatefrom the 40th districtIn officeDe...

Seorang pria melakukan perebutan di Capital Bocking USA Meetup. Egrang lompat, egrang pantul, atau egrang pegas merupakan egrang khusus yang memungkinkan penggunanya berlari, melompat, dan melakukan berbagai akrobatik. Egrang pegas yang menggunakan pegas daun fiberglass dipatenkan di Amerika Serikat pada tahun 2004 dengan merek dagang PowerSkip, dipasarkan untuk penggunaan rekreasi dan olahraga ekstrim. [1] Keterangan Setiap sepatu terdiri dari sol kaki dengan tali pengunci tipe papan...

2010 song by Rihanna SkinSong by Rihannafrom the album Loud ReleasedNovember 12, 2010Recorded2010StudioWestlake Recording Studios (Los Angeles, California), Studio at the Palms (Paradise, Nevada)GenreR&BLength5:04Label Def Jam SRP Songwriter(s) Ursula Yancy Kenneth Coby Robyn Fenty Producer(s) Soundz Makeba Riddick Kuk Harrell Audio videoSkin on YouTube Skin is a song by Barbadian recording artist Rihanna from her fifth studio album, Loud (2010). The song was written by Kenneth Coby, Ursu...

Bukit Patang merupakan sebuah bukit yang terdapat di negara bagian Terengganu Darul Iman, Malaysia. Tingginya 629 meter. Bukit Patang mempunyai kawasan hutan Dipterokarp Bukit, dan hutan Dipterokarp Atas. Artikel bertopik geografi atau tempat Malaysia ini adalah sebuah rintisan. Anda dapat membantu Wikipedia dengan mengembangkannya.lbs

この項目には、一部のコンピュータや閲覧ソフトで表示できない文字が含まれています(詳細)。 数字の大字(だいじ)は、漢数字の一種。通常用いる単純な字形の漢数字(小字)の代わりに同じ音の別の漢字を用いるものである。 概要 壱万円日本銀行券(「壱」が大字) 弐千円日本銀行券(「弐」が大字) 漢数字には「一」「二」「三」と続く小字と、「壱」「�...

Questa pagina contiene una traduzione, completa o parziale, della pagina originale:«Template:Mental and behavioral disorders» tratta da Wikipedia in inglese. Consulta la cronologia della pagina originale per conoscere l'elenco degli autori. Modifica template Si è resa necessaria una modifica del template, che era decisamente difficile da leggere e seguire. In seguito a richiesta del progetto psicologia (nella persona di Dapifer) mi sono impegnata a cercare una soluzione, che mi è stata g...

هنودمعلومات عامةنسبة التسمية الهند التعداد الكليالتعداد قرابة 1.21 مليار[1][2]تعداد الهند عام 2011ق. 1.32 مليار[3]تقديرات عام 2017ق. 30.8 مليون[4]مناطق الوجود المميزةبلد الأصل الهند البلد الهند الهند نيبال 4,000,000[5] الولايات المتحدة 3,982,398[6] الإمار...

Dalam nama Spanyol ini, nama keluarganya adalah Sosa. Arturo SosaSJPetinggi Umum Serikat Yesus(XXXI)Sosa pada Januari 2017Awal masa jabatan14 Oktober 2016PendahuluAdolfo NicolásImamatTahbisan imam30 Juli 1977Informasi pribadiNama lahirArturo Marcelino Sosa AbascalLahir12 November 1948 (umur 75)Caracas, VenezuelaKewarganegaraanVenezuelaAlmamaterUniversidad Católica Andrés Bello (Sarjana)Universidad Central de Venezuela (Doktor) Arturo Marcelino Sosa Abascal SJ (lahir 12 November 1948) ...

В Википедии есть статьи о других людях с фамилией Аметистов. Тихон Александрович Аметистов Дата рождения 27 октября 1884(1884-10-27) Место рождения Санкт-Петербург, Российская империя Дата смерти 28 декабря 1941(1941-12-28) (57 лет) Место смерти Париж, Париж Награды и премии Медиа...

Basij women protest the JCPOA outside the Iranian parliament The Joint Comprehensive Plan of Action, more commonly known as the Iran nuclear deal, was the international agreement reached on Iran's nuclear program in Vienna in 2015. The deal, made after several years of negotiation, set in place strict guidelines to regulate and oversee the Iranian nuclear program including the reduction of centrifuges, enriched uranium stockpiles, and an agreement to allow regular inspections of nuclear site...
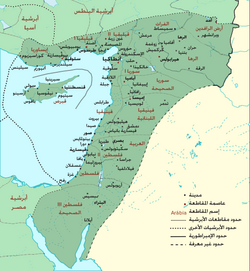
أبرشية الشرق الأبرشية المشرقية أبرشية بيزنطية 314 – 535 خارطة للأبرشية المشرقية التابعة للإمبراطورية البيزنطية، حيث تظهر مقاطعاتها ومراكزها وأهم مدنها في عام 400 م. عاصمة أنطاكيا نظام الحكم أبرشية رومانية اللغة القائمة .. اللغة الرسمية والأساسية:اللاتينية واليونانية ا...

Cet article est une ébauche concernant les Jeux olympiques et l’Argentine. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants. Argentine aux Jeux olympiques d'été de 1932 Code CIO ARG Lieu Los Angeles Participation 6e Athlètes 33 Porte-drapeau Alberto Zorrilla MédaillesRang : 11e Or3 Arg.1 Bron.0 Total4 Argentine aux Jeux olympiques d'été Argentine aux Jeux olympiques d'été de 1928 Argentine aux Jeux...



