Reacción química
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

Hethum IՀեթում ԱHethum I bersama Isabella, Ratu Armenia pada sebuah koinRaja KilikiaPendahuluIsabellaPenerusLeo IIInformasi pribadiAyahKonstantinus, Penguasa BaberonIbuPutri Alix Pahlavouni dari LampronPasanganIsabellaAnakEuphemiaMariaSybilleRitaLeo IIThoros Hethum I (1213—21 Oktober 1270) (juga ditransliterasikan Hethoum, Hetoum, Het'um, atau Hayton dari bahasa Armenia: Հեթում Armen) adalah seorang raja yang memerintah Kerajaan Armenia Kilikia (juga dikenal sebagai Armenia Kec...

Artikel ini membahas mengenai bangunan, struktur, infrastruktur, atau kawasan terencana yang sedang dibangun atau akan segera selesai. Informasi di halaman ini bisa berubah setiap saat (tidak jarang perubahan yang besar) seiring dengan penyelesaiannya. Providence TowerInformasi umumLokasiDubai, Uni Emirat ArabPerkiraan rampung2008Data teknisJumlah lantai57Desain dan konstruksiArsitekConser Consulting EngineersPengembangMiddle East Development LLC. Providence Tower merupakan sebuah menara bert...

Campionato Nazionale Under-18Sport Calcio TipoClub FederazioneFIGC Paese Italia OrganizzatoreSettore Giovanile e Scolastico TitoloCampione d'Italia Under-18 Aperturaottobre Chiusuragiugno Partecipanti21 squadre Formulafase a gironi (stagione regolare) + eliminazione diretta (semifinali e finale per assegnazione titolo) StoriaFondazione2019 Numero edizioni4 Detentore SPAL Record vittorie SPAL (2) Trofeo o riconoscimento Modifica dati su Wikidata · Manuale Il Campionato Naz...

عقد 2010معلومات عامةجزء من القرن 21 بتاريخ عقد 2010 تاريخ البدء 1 يناير 2010 تاريخ الانتهاء 31 ديسمبر 2019 وسم 2010s لديه جزء أو أجزاء 201020112012 عقد 2000 عقد 2020 تعديل - تعديل مصدري - تعديل ويكي بيانات عقد 1980 | عقد 1990 | عقد 2000 | عقد 2010 | عقد 2020 | عقد 2030 | عقد 2040 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 عقد ...

'كدكن' مدينة الإحداثيات 35°35′05″N 58°52′41″E / 35.58472°N 58.87806°E / 35.58472; 58.87806 تقسيم إداري البلد إيران[1] عدد السكان المجموع 71٬871 عدد الذكور 1827 (2016)[2] عدد الإناث 1892 (2016)[2] رمز جيونيمز 129846 تعديل مصدري - تعديل كدكن هي مدينة إيرانية تقع ...

This article relies excessively on references to primary sources. Please improve this article by adding secondary or tertiary sources. Find sources: Macintosh IIfx – news · newspapers · books · scholar · JSTOR (April 2023) (Learn how and when to remove this template message) Personal computer by Apple Macintosh IIfxDeveloperApple ComputerProduct familyMacintosh IIRelease dateMarch 19, 1990 (1990-03-19)Introductory priceUS$8,969 (equi...

ロバート・デ・ニーロRobert De Niro 2011年のデ・ニーロ生年月日 (1943-08-17) 1943年8月17日(80歳)出生地 アメリカ合衆国・ニューヨーク州ニューヨーク市身長 177 cm職業 俳優、映画監督、映画プロデューサージャンル 映画、テレビドラマ活動期間 1963年 -配偶者 ダイアン・アボット(1976年 - 1988年)グレイス・ハイタワー(1997年 - )主な作品 『ミーン・ストリート』(1973年)...

American politician (1770–1837) Abner LacockUnited States Senatorfrom PennsylvaniaIn officeMarch 4, 1813 – March 4, 1819Preceded byAndrew GreggSucceeded byWalter LowrieMember of the U.S. House of Representativesfrom Pennsylvania's 11th districtIn officeMarch 4, 1811 – March 3, 1813Preceded bySamuel SmithSucceeded byWilliam FindleyMember of the Pennsylvania SenateIn office1808-1810Member of the Pennsylvania State LegislatureIn office1801-18031804-18081832-18...

Франц Саксен-Кобург-Заальфельдскийнем. Franz von Sachsen-Coburg-Saalfeld герцог Саксен-Кобург-Заальфельдский 8 сентября 1800 — 9 декабря 1806 Предшественник Эрнст Фридрих Саксен-Кобург-Заальфельдский Преемник Эрнст I Саксен-Кобург-Заальфельдский Рождение 15 июля 1750(1750-07-15)Кобург, Сакс...

VégèceFonctionFonctionnaire (en)BiographieDécès Vers 450Nom dans la langue maternelle Publius Flavius Vegetius RenatusÉpoque Bas-Empire romainActivités Écrivain, historien, médecin, poète, militaire, haut fonctionnaireGens FlaviiŒuvres principales Epitoma rei militarismodifier - modifier le code - modifier Wikidata Végèce (Publius Flavius Vegetius Renatus) est un écrivain romain de la fin du IVe et de la première moitié du Ve siècle de l’ère chrétienne, auteur de troi...

Universitas Otagobahasa Inggris: University of Otago bahasa Māori: Te Whare Wānanga o OtāgoKampus universitasMotobahasa Latin: Sapere audeMoto dalam bahasa IndonesiaBerani untuk menjadi bijak (Dare to be wise)JenisNegeriDidirikan1869KanselirJohn WardWakil KanselirHarlene HayneStaf administrasi3.788 (2014)[1]Jumlah mahasiswa20.942 (2014)[1]Sarjana15.635 (2014)[1]Magister4.378 (2014)[1]Doktor1.388 (2014)[1]LokasiDunedin, Otago, Selandi...

Expressway in Hiroshima and Shimane prefecture, Japan Hamada Expressway 浜田自動車道Route informationLength56.6 km (35.2 mi)Existed1989–presentMajor junctionsFromChiyoda Junction in Kitahiroshima, Hiroshima Chūgoku ExpresswayToHamada Interchange in Hamada, Shimane National Route 9 LocationCountryJapanMajor citiesŌnan Highway system National highways of Japan Expressways of Japan The Hamada Expressway (浜田自動車道, Hamada Jidōsha-dō) is a national express...

Singapore grip redirects here. For the novel, see The Singapore Grip. In the cowgirl position, the man is passive while the woman takes the initiative. (Illustration by Édouard-Henri Avril) Sexual intercourse technique Pompoir is a sexual technique in which the woman uses her vaginal muscles to stimulate the man's penis.[1][2][3][4][5] Both partners remain still, while the woman strokes the man's erection using rhythmic, rippling pulses of the pubococc...

Since 1980, Portugal has submitted films for the Academy Award for Best International Feature Film[nb 1] every year but one (1981). The award is given annually by the United States Academy of Motion Picture Arts and Sciences to a feature-length motion picture produced outside the United States that contains primarily non-English dialogue.[3] Forty Portuguese films have been submitted to the Academy for consideration for the Academy Award for Best Foreign Language Film. As of ...

奈良久留美全名Kurumi Nara國家/地區 日本居住地日本兵庫縣川西市出生 (1991-12-30) 1991年12月30日(32歲)日本大阪府箕面市身高159體重55轉職業年2009年持拍右手持拍(雙手反拍)職業獎金$2,425,339美元單打成績職業戰績310–255(54.87%)冠軍頭銜(WTA)1(ITF)5最高排名32(2014年8月18日)現今排名238(2019年5月27日)大滿貫單打成績澳網第三輪(2014)法網第二輪(2014,2015,2016,2017,2...

Den här artikeln handlar om den spanska provinsen Las Palmas. För staden på ön Gran Canaria, se Las Palmas de Gran Canaria. Las Palmas Provinsen Las Palmas Flagga Stadsvapen Land Spanien Autonom region Kanarieöarna Yta 4 066 km² Folkmängd 1 070 032 (2008) Befolkningstäthet 263 invånare/km² Geonames 2515271 Provincia de Las Palmas är en spansk provins i den autonoma regionen Kanarieöarna utanför Afrikas nordvästra kust. Provinsen innefattar den...
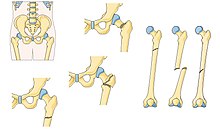
كسر الفخذ كسر الفخذ معلومات عامة الموقع التشريحي عظم فخذ تعديل مصدري - تعديل كسر الفخذ (بالإنجليزية: Femoral fracture) عبارة عن كسر عظم الفخذ، وعادةً ما يتم تحمل الكسر في حالات الصدمات شديدة التأثير مثل حوادث السيارات نظرًا للكمية الكبيرة من القوة اللازمة لكسر هذه العظمة،...

明治学院大学体育会サッカー部原語表記 明治学院大学体育会サッカー部呼称 明治学院大学愛称 明学クラブカラー イエロー所属リーグ 関東大学サッカーリーグ戦所属ディビジョン 3部ホームタウン 神奈川県横浜市ホームスタジアム ヘボンフィールド代表者 佐藤努監督 加藤望公式サイト 公式サイト ホームカラー ■テンプレート(■ノート)■サッカー...

District of Andaman and Nicobar Islands in IndiaSouth Andaman districtDistrict of Andaman and Nicobar IslandsSouth Andaman districtShow map of Andaman and Nicobar IslandsSouth Andaman districtShow map of IndiaCoordinates: 11°40′12″N 92°44′24″E / 11.67000°N 92.74000°E / 11.67000; 92.74000Country IndiaUnion territory Andaman and Nicobar IslandsHeadquarterSri Vijaya PuramTime zoneUTC+5:30 (IST)Websitesouthandaman.nic.in South Andaman district is one of th...

Disambiguazione – Weißwasser rimanda qui. Se stai cercando altri significati, vedi Weißwasser (disambigua). Questa voce sull'argomento centri abitati della Sassonia è solo un abbozzo. Contribuisci a migliorarla secondo le convenzioni di Wikipedia. Weißwasser/OberlausitzGrande città circondariale(DE) Weißwasser/O.L.(HSB) Běła Woda Weißwasser/Oberlausitz – Veduta LocalizzazioneStato Germania Land Sassonia DistrettoDresda CircondarioGörlitz TerritorioCoordina...





![{\displaystyle \sum _{i=1}^{N}{\nu _{i}[C_{i}]}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/384d13833021b4ff496a534b901e448305c0cb8d)






