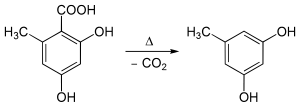
Descarboxilación
|
Read other articles:

Cet article est une ébauche concernant une localité italienne et la Lombardie. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants. Casalmoro Administration Pays Italie Région Lombardie Province Mantoue Code postal 46040 Code ISTAT 020010 Code cadastral B901 Préfixe tel. 0376 Démographie Population 2 243 hab. (31-12-2010[1]) Densité 173 hab./km2 Géographie Coordonnées 45° 16�...

Persemakmuran BahamaCommonwealth of the Bahamas (Inggris) Bendera Lambang Semboyan: Forward Upward Onward Together(Maju Bersama ke Depan dan Atas)Lagu kebangsaan: March On, Bahamaland (Terus maju, tanah Bahama) Lagu kerajaan: God Save the King (Tuhan Menjaga sang Raja) Perlihatkan BumiPerlihatkan peta BenderaIbu kota(dan kota terbesar)Nassau25°4′N 77°20′W / 25.067°N 77.333°W / 25.067; -77.333Bahasa resmiInggrisBahasa daerahKreol BahamaKelompok&#...

Polish offshoot of the Czech Sokol movement Falcon Polish Gymnastic SocietyFounded7 February 1867; 157 years ago (1867-02-07)FounderJan Żaplachta-Zapałowicz, Józef Milleret[1]Founded atLwów, Kingdom of Galicia and LodomeriaTypegymnastics societyHeadquartersWarsaw, PolandRegion served Poland Sokół (Polish: [ˈsɔkuw] ⓘ, English: Falcon), or in full the Polskie Towarzystwo Gimnastyczne Sokół (English: Falcon Polish Gymnastic Society), is the Polish of...

This article is about the historic Royal Italian Army 131st Armored Division Centauro. For the historic Royal Italian Army namesake division, see 136th Armored Legionary Division Centauro. For the historic Italian Army division and later brigade, see Armored Brigade Centauro. 131st Armored Division Centauro131st Armored Division Centauro insigniaActive20 April 1939 - 18 April 1943Country Kingdom of ItalyBranch Royal Italian ArmyTypeArmoredSizeDivisionGarrison/HQSienaEngagementsWorld...

Election in Baltimore, Maryland, US 1991 Baltimore mayoral election ← 1987 November 15, 1991 1995 → Candidate Kurt Schmoke Samuel A. Culotta Party Democratic Republican Popular vote 66,969 25,859 Percentage 72.14% 27.86% Mayor before election Kurt Schmoke Democratic Elected Mayor Kurt Schmoke Democratic Elections in Maryland Federal government Presidential elections 1788–89 1792 1796 1800 1804 1808 1812 1816 1820 1824 1828 1832 1836 1840 1844 1848 1852 1856...

Chronologies Chronologie du sport 1961 1962 1963 1964 1965 1966 1967Mois :Jan - Fév - Mar - Avr - Mai - Juin Juil - Aoû - Sep - Oct - Nov - Déc 1963 ◄◄ 1964 en sport ►► 1965 Chronologie dans le monde 1961 1962 1963 1964 1965 1966 1967Décennies :1930 1940 1950 1960 1970 1980 1990Siècles :XVIIIe XIXe XXe XXIe XXIIeMillénaires :-Ier Ier IIe IIIe Chronologies géographiques Afrique Afrique du Sud, Algé...

You can help expand this article with text translated from the corresponding article in Spanish. (September 2023) Click [show] for important translation instructions. Machine translation, like DeepL or Google Translate, is a useful starting point for translations, but translators must revise errors as necessary and confirm that the translation is accurate, rather than simply copy-pasting machine-translated text into the English Wikipedia. Consider adding a topic to this template: there a...

Weekly magazine based in New York City For the 1978–1989 Australia North Queensland current affairs television program, see Newsweek (TV program). NewsweekCover of the September 5, 1983, issueEditor-in-chiefNancy Cooper[1]Former editorsMalcolm Muir (1937–1959)Osborn Elliott (1961–1976)[2]Jon Meacham (2006–2010)[3]CategoriesMagazine, publisherPublisherDev Pragad [4][5], President and CEOTotal circulation(2015)100,000[6]First issueFebruary...

内華達州 美國联邦州State of Nevada 州旗州徽綽號:產銀之州、起戰之州地图中高亮部分为内華達州坐标:35°N-42°N, 114°W-120°W国家 美國建州前內華達领地加入聯邦1864年10月31日(第36个加入联邦)首府卡森城最大城市拉斯维加斯政府 • 州长(英语:List of Governors of {{{Name}}}]]) • 副州长(英语:List of lieutenant governors of {{{Name}}}]])喬·隆巴爾多(R斯塔...

Theme park in Valencia, California This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Six Flags Magic Mountain – news · newspapers · books · scholar · JSTOR (February 2021) (Learn how and when to remove this message) Six Flags Magic MountainPreviously known as Magic Mountain (1971–1979)The entrance archway to...

Eastern Kentucky University athletic teams This article is about the EKU sports teams. For other uses, see Kentucky Colonel (disambiguation). Eastern Kentucky ColonelsUniversityEastern Kentucky UniversityConferenceASUN Conference (primary)United Athletic Conference (football)NCAADivision I (FCS)Athletic directorMatt RoanLocationRichmond, KentuckyVarsity teams16 (7 men's, 9 women's)Football stadiumRoy Kidd StadiumBasketball arenaAlumni ColiseumBaseball stadiumTurkey Hughes FieldSoftball stadiu...

Si ce bandeau n'est plus pertinent, retirez-le. Cliquez ici pour en savoir plus. Certaines informations figurant dans cet article ou cette section devraient être mieux reliées aux sources mentionnées dans les sections « Bibliographie », « Sources » ou « Liens externes » (juillet 2017). Vous pouvez améliorer la vérifiabilité en associant ces informations à des références à l'aide d'appels de notes. Front national des musiciensHistoireFondation Mai ...

Prime Minister of Portugal from 1968 to 1974 In this Portuguese name, the first or maternal family name is Neves and the second or paternal family name is Alves Caetano. Marcelo CaetanoGCTE GCCPrime Minister of PortugalIn office27 September 1968 – 25 April 1974PresidentAmérico TomásPreceded byAntónio de Oliveira SalazarSucceeded byNational Salvation JuntaMinister of Foreign AffairsActing6 October 1969 – 15 January 1970Prime MinisterHimselfPreceded byAlberto Franco...

ميّز عن عمل تطوعي. يعرف التطوع بأنه «الجهد الذي يبذله أي إنسانٍ بمقابل أو بدون مقابل لمجتمعه، بدافعٍ منه للإسهام في تحمل مسؤولية المؤسسة التي تعمل على تقديم الرعاية الاجتماعية» (اللحياني، 1984: 29)، كما يعرفه العلي (1416هـ: 760): بأنه «بذل مالي أو عيني أو بدني أو فكري يقدمه ا�...

Theatre in Lisbon, Portugal Teatro da TrindadeAddressLargo da TrindadeLisbonPortugalCoordinates38°42′42″N 09°08′33″W / 38.71167°N 9.14250°W / 38.71167; -9.14250OwnerINATELConstructionOpened30 November 1867ArchitectMiguel Evaristo de Lima Pinto The Teatro da Trindade is a theatre in the Chiado neighbourhood of Lisbon, Portugal, built in the 19th century. It is one of the oldest theatres in Lisbon still in operation. Construction and opening In 1866, Francisc...

Mongol-led dynasty of China (1271–1368) Great Yuan大元Dà Yuán (Chinese)ᠳᠠᠢᠦᠨᠤᠯᠤᠰDai Ön ulus (Mongolian)[1]1271–1368Yuan dynasty (c. 1290)[note 1]StatusKhagan-ruled division of the Mongol Empire[note 2]Conquest dynasty of Imperial ChinaCapitalKhanbaliq (now Beijing)Shangdu (summer capital)Common languagesMiddle MongolChinese (Old Mandarin)Old UyghurOfficial script'Phags-pa script[5]Religion Buddhism (Tibetan Buddhi...

Stadium in Canberra, Australia GIO Stadium CanberraFormer namesCanberra StadiumBruce StadiumNational Athletics StadiumLocationBruce, Australian Capital TerritoryCoordinates35°15′0″S 149°6′10″E / 35.25000°S 149.10278°E / -35.25000; 149.10278OwnerAustralian Sports CommissionCapacity25,011[1]Record attendance28,753 – Brumbies vs Crusaders, 2004 Super 12 FinalSurfaceGrassConstructionOpened29 October 1977ArchitectPhilip CoxMain contractorsLeighton Cont...

第三十二届夏季奥林匹克运动会男子100米蝶泳比賽比賽場館東京水上運動中心日期2021年7月29日(预赛)2021年7月30日(半决赛)2021年7月31日(决赛)参赛选手59位選手,來自46個國家和地區冠军成绩49.45 WR奖牌获得者01 ! 凱勒布·德萊賽爾 美国02 ! 米拉克·克里什托夫 匈牙利03 ! 諾亞·龐蒂 瑞士← 20162024 → 2020年夏季奥林匹克运动会游泳比赛�...

В Википедии есть статьи о других людях с такой фамилией, см. Третьяков; Третьяков, Павел. Павел Третьяков Портрет работы Ильи Репина (1883) Дата рождения 15 (27) декабря 1832 Место рождения Москва, Российская империя[1] Дата смерти 4 (16) декабря 1898 (65 лет) Место смерти Москв�...

Canadian online media company Narcity Media Inc.FormerlyMTL Blog Inc. (2013–2015)Company typePrivateIndustryMediaAdvertisingComputer softwareTechnologyFounded2013; 11 years ago (2013)[1] in Montreal, Quebec, CanadaFoundersCharles Lapointe Joshua McRaeHeadquartersToronto, Ontario, Canada[1]Key peopleCharles Lapointe (CEO) Érik Desjardins (Ex-CTO)[1] Adrian Borowski (Ex-COO)[1] Chrjapin Kelly J. (Ex-CFO)[1]ServicesOnline servicesWebsi...