| Strukturformel
|

|
| Allgemeines
|
| Name
|
Tetraacetylethylendiamin
|
| Andere Namen
|
- TAED
- N-Acetyl-N-[2-(diacetylamino)ethyl]acetamid
- N,N,N′,N′-Tetraacetylethylendiamin
- N,N′-Ethylenbis(N-acetylacetamid)
|
| Summenformel
|
C10H16N2O4
|
| Kurzbeschreibung
|
beige Kristalle[1]
|
| Externe Identifikatoren/Datenbanken
|
|
|
| Eigenschaften
|
| Molare Masse
|
228,25 g·mol−1
|
| Aggregatzustand
|
fest
|
| Schmelzpunkt
|
149–154 °C[1]
|
| Löslichkeit
|
schwer löslich in Wasser (1 g/l bei 20 °C)[1]
|
| Sicherheitshinweise
|
|
|
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa).
|
Tetraacetylethylendiamin (TAED) ist ein tertiäres Amid, das als Aktivator von Bleichmitteln in Waschmitteln eingesetzt wird. Da TAED in wässrigem Medium nicht langzeitstabil ist, wird es ausschließlich als Granulat in festen und als Suspension in wasserfreien flüssigen Detergentienzubereitungen eingesetzt.
Vorkommen
Tetraacetylethylendiamin ist ein häufig verwendeter Bestandteil verschiedener Waschmittel. TAED gehört zu einer größeren Gruppe aktiver ungeladener N- und O-Acylverbindungen (wie z. B. Tetraacetylglycoluril oder Glucosepenta-acetat) und hat seine dominante Marktposition mit einer Gesamtproduktionsmenge von über 80,000 Tonnen/Jahr[3] in Europa gegenüber zwischenzeitlich entwickelten anionischen (z. B. Natrium-Nonanoyloxybenzolsulfonat NOBS) und kationischen (z. B. Nitrilquats) Bleichaktivatoren behauptet.
Pulverförmige Universalwaschmittel haben einen Anteil von 1–3 % TAED, während sogenannte Waschmittelkonzentrate 4–6 % und Compactwaschmittel 6–8 % TAED enthalten.[4]
Einen hohen Bekanntheitsgrad innerhalb der Bevölkerung erlangte TAED in den auslaufenden 1970er-Jahren durch einen Werbespot des Waschmittels OMO, in dessen Slogan es hieß: „OMO, mit TAED-System“.
Herstellung
TAED wird in einem zweistufigen Prozess aus Ethylendiamin und Acetanhydrid hergestellt.[5]
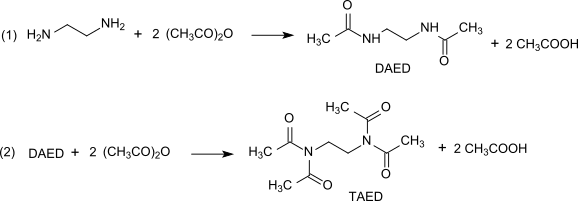
Reaktion (1) liefert das symmetrisch diacetylierte Zwischenprodukt DAED. Reaktion (2) führt bei Temperaturen von 120 bis 170 °C mit einem Überschuss von Acetanhydrid zu einer Gleichgewichtsverteilung zwischen TAED, Diacetylethylendiamin (DAED) und Triacetylethylendiamin und erzeugt unerwünschte dunkelbraune Verunreinigungen. Um ein reines, weißes und geruchsloses Produkt zu erhalten, wird das Reaktionsgemisch mit Aktivkohle entfärbt[5], das TAED durch Vakuumdestillation isoliert[6] oder das nach Abkühlen des Gemischs kristallin anfallende TAED mit Essigsäure und Wasser gewaschen und getrocknet.[7] Die großtechnisch durchgeführte Reaktion verläuft praktisch quantitativ. Die in erheblichen Mengen in der Reaktion anfallende Essigsäure kann durch Flüssig-Flüssig-Extraktion oder Destillation gereinigt und in die Herstellung von Acetanhydrid zurückgeführt werden.
Eigenschaften
Wegen der unbefriedigenden Langzeitstabilität des pulverförmigen TAEDs in festen Waschmittelzubereitungen wird es unter Zuhilfenahme des Natriumsalzes von Carboxymethylcellulose (Na-CMC) granuliert[8] und das Granulat mitunter noch beschichtet bzw. blau oder grün eingefärbt. Das Granulat löst sich trotz der relativ geringen Kaltwasserlöslichkeit des TAEDs (1 g/l bei 20 °C) wegen seiner niedrigen Konzentration im Waschpulver sehr schnell und vollständig in der Waschflotte. TAED zerfällt bei der sogenannten Perhydrolyse, der Reaktion mit Wasserstoffperoxid aus dem Bleichmittel Percarbonat unter den Bedingungen eines Waschprozesses (pH 10) bereits bei 23 °C zu >99 % zu DAED, das zwar relativ hydrolysestabil, aber leicht bioabbaubar ist. Die gebildete Peroxyessigsäure hat bakterizide, viruzide und fungizide Eigenschaften und zerstört rasch >99,99 % der Mikroorganismen. Dadurch wirkt die Kombination von TAED mit Percarbonat desinfizierend und desodorierend.[4]
Verwendung
TAED fungiert in Waschmitteln als Aktivator von Bleichmitteln wie z. B. Natriumperborat oder Natriumpercarbonat. Eine Bleichwirkung solcher peroxidischen Verbindungen kommt ohne TAED erst oberhalb von 60 °C zustande. Der Einsatz von TAED ermöglicht das Bleichen jedoch bereits bei niedrigeren Temperaturen. Dies beruht auf der Reaktion zwischen TAED (1) und dem peroxidischen Bleichmittel bzw. intermediär auftretenden Wasserstoffperoxid unter Bildung von N,N'-Diacetylethylendiamin (2) und Peroxyessigsäure (3):

Diese ist durch ihren schon bei Raumtemperatur eintretenden Zerfall unter Entstehung sogenannten Singulett-Sauerstoffs, einer angeregten, hochreaktiven Sauerstoffspezies, das eigentliche Bleichmittel.
Vergleichsweise geringe TAED-Mengen werden auch zur Bleichung von Papier und Textilien und für die Erzeugung von Peressigsäure zu Desinfektionszwecken eingesetzt. Wegen seiner desinfizierenden und desodorierenden Wirkung werden TAED/Percarbonat-Kombinationen auch in Geschirrspülmitteln und Gebiss- und Zahnspangenreinigern verwendet.
TAED wirkt besser bei der Entfernung hydrophiler Flecken, wie z. B. Tee, Kaffee und Rotwein. Gegenüber hydrophoben Flecken, wie z. B. Gras, Säften und Gewürzen (Curry), ist es weniger wirksam. Der Waschprozess wird durch geeignete Zusatzstoffe im Waschmittel pH-kontrolliert, um bei anfangs ca. pH 10 die schnelle und vollständige Persäurebildung aus dem TAED zu ermöglichen. Die dabei entstehende Essigsäure senkt den pH-Wert ab, wodurch der Abbau der meisten Flecken beschleunigt wird. Als relativ mildes Oxidationsmittel greift die durch TAED-Einwirkung entstehende Peressigsäure (im Gegensatz etwa zum in USA noch weit verbreiteten Bleichmittel Natriumhypochlorit) Textilfarbstoffe und -fasern nur sehr wenig an.[4] Bei Temperaturen unter 40 °C ist die Wirkung von TAED unbefriedigend. Keiner der bisher als unter 40 °C aktiv beschriebenen Bleichaktivatoren hat jedoch auch nur annähernd das ausgewogene Eigenschaftsprofil von TAED.
In wasserhaltigen flüssigen Waschmitteln, deren Marktvolumen weltweit stetig steigt, ist TAED nicht beständig und würde auch mit dem Bleichmittel in Wechselwirkung treten. Versuche, durch Kompartimentierung TAED von Wasserphase und Bleichmittel zu trennen[9], waren bisher wenig erfolgreich.
Ökologie
TAED ist weitestgehend ungiftig und biologisch leicht abbaubar. TAED und seine Vorstufe DAED besitzen eine geringe aquatische Ökotoxizität. TAED zeigt bei allen Expositionsrouten eine sehr geringe Toxizität, wirkt praktisch nicht-reizend auf Haut und Auge und ergibt keine Hinweise auf Hautsensibilisierung. TAED ist weder mutagen noch teratogen.[3]
Einzelnachweise
- ↑ a b c Eintrag zu N,N′-Ethylenbis(N-acetylacetamid) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Juni 2008. (JavaScript erforderlich)
- ↑ Datenblatt N,N,N′,N′-Tetraacetylethylenediamine bei Sigma-Aldrich, abgerufen am 29. Mai 2011 (PDF).
- ↑ a b HERA Human & Environmental Risk Assessment on ingredients of European household cleaning products: Tetraacetylethylenediamine (TAED), CAS-Nummer: 10543-57-4 (PDF; 666 kB), Draft, DECEMBER 2002.
- ↑ a b c Clariant Surfactant Division: The Clean and Clever Way of Bleaching - PERACTIVE (Memento vom 17. Juli 2013 im Internet Archive) (PDF; 865 kB), 08.99
- ↑ a b Europäische Patentanmeldung EPA 004 919, Verfahren zur Herstellung von N,N,N’,N’-Tetraacetyl-ethylendiamin, Erfinder: G. Müller-Schiedmayer, R. Aigner, Anmelder: Hoechst AG, veröffentlicht am 31. Oktober 1979
- ↑ Europäische Patentanmeldung EPA 0 051 739 A1, Verfahren zur Herstellung von N,N,N’,N’-Tetraacetylethylendiamin, Erfinder: W. Köhler et al., Anmelder: BASF AG, veröffentlicht am 19. Mai 1982
- ↑ Europäisches Patent EP 0 238 958 B1, Verfahren zur Reinigung von Tetraacetylethylendiamin, Erfinder: K. Köster, F.-J. Carduck, Anmelder: Henkel KG aA, veröffentlicht am 12. Juni 1991
- ↑ US-Patent US 5,100,576, Process for the preparation of a readily soluble bleach activator granulate with a long shelf life, Erfinder: J. Cramer et al., Anmelder: Hoechst AG, erteilt am 31. März 1992.
- ↑ US-Patent US 6,080,710, Bleach activator compositions, Erfinder: J.D. Withenshaw, M.A. France, Anmelder: Warwick International Group, Ltd., erteilt am 27. Juni 2000, und US-Patent US 5,827,447, Liquid Bleach Agent Composition, Erfinder: Y. Tamura et al., Anmelder: Kao Corp., erteilt am 27. Oktober 1998.