Alkansäuren (Alkancarbonsäuren) sind gesättigte aliphatische Carbonsäuren mit der allgemeinen Formel R–COOH, wobei R für ein Wasserstoffatom oder eine lineare oder verzweigte Alkylgruppe steht.[1] Unsubstituierte Alkansäuren mit einer Carboxygruppe (Monocarbonsäuren) haben die allgemeine Summenformel CnH2n+1COOH (n = 0, 1, 2, 3, …).[2]
Alkansäuren mit einer Carboxygruppe zählen zu den Monocarbonsäuren. Alkansäuren mit zwei Carboxygruppen bezeichnet man als Alkandisäuren und zählen zu den Dicarbonsäuren. Die einfachste Alkansäure ist die Methansäure (R = H), die unter dem Trivialnamen Ameisensäure bekannt ist. Längerkettige Alkansäuren mit sechs oder mehr Kohlenstoffatomen werden auch als gesättigte Fettsäuren bezeichnet.[3]
Die Alkansäuren und ihre Derivate – insbesondere die Salze und Ester – sind von großem kommerziellen Wert, da sie in vielen verschiedenen industriellen Anwendungsbereichen als Lebensmittelzusatzstoffe, Emulgatoren, Aroma- und Duftstoffe bis hin zu Hochleistungsschmierstoffen eingesetzt werden.[1]
Aufbau von Alkansäuren
Die Bezeichnung der Alkansäuren nach IUPAC ergibt sich aus der längstmöglichen Kohlenstoffkette einschließlich der Carboxygruppe. An die Bezeichnung des entsprechenden Alkans wird die Endung -säure hinzugefügt.[4] Alternativ wird das Suffix -carbonsäure mit dem Namen des Kohlenwasserstoffs verknüpft, an den die Carboxygruppe gebunden ist. Grundsätzlich wird für lineare Strukturen mit weniger als drei Carboxylgruppen die erste Variante bevorzugt.[5]
Für viele Alkansäuren sind Trivialbezeichnungen üblich, die sich von ihrer natürlichen Herkunft ableiten.
| Einige lineare und verzweigte Alkansäuren
|
| Strukturformel
|
![]()
|

|
|

|
| IUPAC-Bezeichnung
|
Ethansäure
|
Hexansäure
|
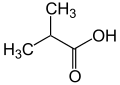
2-Methylpropansäure
|
2,2-Dimethylpropansäure
|
| Alternativbezeichnung
|
Methancarbonsäure
|
Pentancarbonsäure
|
1-Methylethancarbonsäure
|
1,1-Dimethylethancarbonsäure
|
| Trivialname
|
Essigsäure
|
Capronsäure
|
Isobuttersäure
|
Pivalinsäure
|
Bei substituierten Alkansäuren sind ein oder mehrere H-Atome im Alkylrest durch andere Atome oder Atomgruppen ersetzt. Beispiele sind die Halogencarbonsäuren, Hydroxycarbonsäuren und die Aminosäuren.[6] Als Lokanten der funktionellen Gruppen oder Seitenketten werden arabische Ziffern verwendet, wobei die Carboxygruppe Vorrang erhält. Bei der Verwendung von Trivialnamen wird die Position durch griechische Buchstaben gekennzeichnet. Das der Carboxygruppe benachbarte Kohlenstoffatom erhält dabei die α-Position.[4]
| Substituierte Alkansäuren (Beispiele)
|
| Strukturformel
|

|

|

|

|
| IUPAC-Bezeichnung
|
2-Chlorethansäure
|
2-Hydroxyethansäure
|
2-Aminoethansäure
|
2-Brom-3-methylhexandisäure
|
| Trivialname
|
Chloressigsäure
|
Glycolsäure
|
Glycin
|
α-Brom-β-methyladipinsäure
|
Darstellung
Für die Darstellung von Alkansäuren gibt es verschiedene Methoden:[2]
Eigenschaften
Die kürzerkettigen Alkansäuren, insbesondere Butansäure, sind stark übelriechende Flüssigkeiten und reagieren in Wasser sauer.
Längerkettige Alkansäuren sind bei Zimmertemperatur weiße Feststoffe. Aufgrund des polaren Charakters der Carboxygruppe sind die Alkansäuren in der Lage, Wasserstoffbrückenbindungen auszubilden, weswegen sie eine erhöhte Siedetemperatur aufweisen. Die Säurestärke sowie die Fähigkeit, Wasserstoffbrücken auszubilden, nehmen mit ansteigender Kettenlänge ab, da dann der Einfluss der Carboxygruppe auf das Gesamtmolekül abnimmt.
Reaktionen
Dissoziation
In Wasser dissoziieren kürzerkettige Alkansäuren (hier: Essigsäure):

.
Das entstehende Säurerest-Ion wird benannt nach dem am Aufbau der Säure beteiligten Alkan und -oat angehängt (teilweise findet sich auch die Endung -at), also beispielsweise:
Ethan + -oat → Ethanoat-Ion (auch: Acetat-Ion)
Allerdings dissoziieren Alkansäuren nicht vollständig, das heißt, nur ein Teil der Alkansäuremoleküle geben ein Wasserstoffion ab. In der Regel sind Alkansäuren also schwache Säuren, was sich in der Säurestärke ausdrückt.
Veresterung
Erwärmt man ein Gemisch aus einer Alkansäure und einem Alkohol in einem Wasserbad, so findet eine Veresterung statt. Dies geschieht in Anwesenheit einer anorganischen Säure als Katalysator, meist konzentrierte Schwefelsäure. Dabei reagiert die OH-Gruppe des Alkohols mit der COOH-Gruppe der Alkansäure und es wird unter Abspaltung von Wasser ein Ester gebildet:

.
Vollständige Oxidation
Alkansäuren werden bei der Verbrennung zu Kohlenstoffdioxid und Wasser oxidiert:

.
Ethansäure wird durch Sauerstoff zu Kohlenstoffdioxid und Wasser oxidiert.
Ist das Sauerstoff-Angebot in der Luft nicht ausreichend, entstehen statt Kohlenstoffdioxid Kohlenstoffmonoxid oder Kohlenstoff (in Form von Ruß).
Homologe Reihe der linearen Alkansäuren
| Trivialname |
Chemische
Bezeichnung |
C-Atome |
Summenformel |
Strukturformel |
Schmelzpunkt
in °C[7] |
Siedepunkt
in °C[7] |
pKs-Wert[8]
|
| Ameisensäure |
Methansäure |
1 |
CH2O2 |
 |
−08,3 |
101 |
3,75 (25 °C)
|
| Essigsäure |
Ethansäure |
2 |
C2H4O2 |
 |
−16,64 |
117,9 |
4,756 (25 °C)
|
| Propionsäure |
Propansäure |
3 |
C3H6O2 |
 |
−20,5 |
141,15 |
4,87 (25 °C)
|
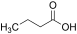
| Buttersäure |
Butansäure |
4 |
C4H8O2 |
 |
0−5,1 |
163,75 |
4,83 (25 °C)
|
| Valeriansäure |
Pentansäure |
5 |
C5H10O2 |
 |
−33,6 |
186,1 |
4,83 (20 °C)
|
| Capronsäure |
Hexansäure |
6 |
C6H12O2 |
 |
0−4 |
205,2 |
4,85 (25 °C)
|
| Önanthsäure |
Heptansäure |
7 |
C7H14O2 |
 |
0−7,2–7,5 |
222,2 |
4,89 (25 °C)
|
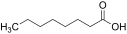
| Caprylsäure |
Octansäure |
8 |
C8H16O2 |
 |
−16,5 |
239 |
4,89 (25 °C)
|
| Pelargonsäure |
Nonansäure |
9 |
C9H18O2 |
 |
−12,4 |
254,5 |
4,96 (25 °C)
|
| Caprinsäure |
Decansäure |
10 |
C10H20O2 |
 |
−31,4 |
268,7 |
|
Weitere Fettsäuren sind die Palmitinsäure (Hexadecansäure, C15H31COOH) und die Stearinsäure (Octadecansäure, C17H35COOH).
Quellen
Weblinks
Einzelnachweise
- ↑ a b Jens Kubitschke, Horst Lange, Heinz Strutz: Ullmann’s Encyclopedia of Industrial Chemistry. John Wiley & Sons, Ltd, 2014, ISBN 978-3-527-30673-2, Carboxylic Acids, Aliphatic, S. 1–18, doi:10.1002/14356007.a05_235.pub2.
- ↑ a b Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie. 18. Auflage. S. Hirzel Verlag, Stuttgart 1978, ISBN 3-7776-0342-2, S. 197 ff.
- ↑ David J. Anneken, Sabine Both, Ralf Christoph, Georg Fieg, Udo Steinberner, Alfred Westfechtel: Ullmann’s Encyclopedia of Industrial Chemistry. John Wiley & Sons, Ltd, 2006, ISBN 978-3-527-30673-2, Fatty Acids, S. 73–116, doi:10.1002/14356007.a10_245.pub2.
- ↑ a b Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 260 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieter Hellwinkel: Die systematische Nomenklatur der Organischen Chemie: Eine Gebrauchsanweisung. 2. Auflage. Springer-Verlag, Berlin, Heidelberg 1978, ISBN 978-3-540-08796-0, S. 113 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie. 18. Auflage. S. Hirzel Verlag, Stuttgart 1978, ISBN 3-7776-0342-2, S. 231 ff.
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-1 – 3-523.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 8-42 – 8-51.