| Trichlorid fosforylu |
|---|
 Geometrie molekuly trichloridu fosforylu |
| Obecné |
|---|
| Systematický název | trichlorid fosforylu |
|---|
| Triviální název | chlorid fosforylu |
|---|
| Ostatní názvy | trifosforylchlorid
fosforylchlorid
oxychlorid fosforečný
trichlorid-oxid fosforečný |
|---|
| Anglický název | Phosphoryl trichloride |
|---|
| Německý název | Phosphoroxychlorid |
|---|
| Sumární vzorec | POCl3 |
|---|
| Vzhled | bezbarvá kapalina, na vlhkém vzduchu dýmající |
|---|
| Identifikace |
|---|
| Registrační číslo CAS | 10025-87-3 |
|---|
| EC-no (EINECS/ELINCS/NLP) | 233-046-7 |
|---|
| Indexové číslo | 015-009-00-5 |
|---|
| PubChem | 24813 |
|---|
| ChEBI | 30336 |
|---|
| UN kód | 1810 |
|---|
| SMILES | O=P(Cl)(Cl)Cl |
|---|
| InChI | InChI=1S/Cl3OP/c1-5(2,3)4 |
|---|
| Číslo RTECS | TH4897000 |
|---|
| Vlastnosti |
|---|
| Molární hmotnost | 153,33 g/mol |
|---|
| Teplota tání | 1,37 °C |
|---|
| Teplota varu | 105,4 °C |
|---|
| Hustota | 1,648 g/cm3
1,675 g/cm3 (20 °C) |
|---|
| Dynamický viskozitní koeficient | 1,065 cP |
|---|
| Index lomu | nD= 1,460 |
|---|
| Kritická teplota Tk | 331,9 °C |
|---|
| Rozpustnost ve vodě | hydrolýza |
|---|
Rozpustnost v polárních
rozpouštědlech | alkoholy (reaguje)
ethery |
|---|
Rozpustnost v nepolárních
rozpouštědlech | kapalné uhlovodíky
chlorované uhlovodíky |
|---|
| Relativní permitivita εr | 13,9 (22 °C)
13,7 (25 °C) |
|---|
| Měrná magnetická susceptibilita | −5,64×10−6 cm3g−1 |
|---|
| Povrchové napětí | 31,6 mN/m |
|---|
| Struktura |
|---|
| Tvar molekuly | čtyřstěnný |
|---|
| Dipólový moment | 8,01×10−30 Cm |
|---|
| Termodynamické vlastnosti |
|---|
| Standardní slučovací entalpie ΔHf° | −597,5 kJ/mol |
|---|
| Standardní molární spalná entalpie ΔH°sp | −130,224 kJ/mol |
|---|
| Entalpie tání ΔHt | 85,4 J/g |
|---|
| Entalpie varu ΔHv | 225 J/g |
|---|
| Standardní molární entropie S° | 222,5 JK−1mol−1 |
|---|
| Standardní slučovací Gibbsova energie ΔGf° | −521,3 kJ/mol |
|---|
| Izobarické měrné teplo cp | 0,905 JK−1g−1 |
|---|
| Bezpečnost |
|---|
 GHS05 GHS05 GHS06 GHS06 GHS07 GHS07 GHS08 GHS08
Nebezpečí[1] |
| H-věty | H330 H372 H302 H314 EUH014 EUH029 |
|---|
| R-věty | R14 R22 R26 R35 R48/23 |
|---|
| S-věty | S1/2 S7/8 S26 S36/37/39 S45 |
|---|
| NFPA 704 | |
|---|
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa).
|
Trichlorid fosforylu (též chlorid fosforylu, trifosforylchlorid, fosforylchlorid nebo oxychlorid fosforečný) je bezbarvá kapalina se vzorcem POCl3. Na vlhkém vzduchu hydrolyzuje na kyselinu fosforečnou za uvolnění chlorovodíku. Průmyslově se vyrábí z chloridu fosforitého a kyslíku nebo oxidu fosforečného. Používá se hlavně na výrobu esterů kyseliny fosforečné (organofosfátů), například trikresylfosfátu.
Struktura
Trichlorid fosforylu má čtyřstěnnou molekulu. Ta obsahuje tři vazby P-Cl a jednu velmi silnou dvojnou vazbu P=O, jejíž vazebná energie se odhaduje na 533,5 kJ/mol. Na základě délky vazby a elektronegativity lze podle Schomakerova–Stevensonova pravidla vyvodit, že forma dvojné vazby je velmi dominantní (na rozdíl od případu POF3). Vazba P=O není podobná π-vazbě v karbonylové skupině, jako například v ketonech. Vhodný popis interakce fosforu a kyslíku je předmětem dlouhých diskusí. Starší knihy upřednostňují popis uplatňující účast orbitalu d na fosforu. Některé z těchto orbitalů směřují k atomu kyslíku a překrývají se s orbitalem p na kyslíku. Modernější texty preferují popis, kde vazba π obsahuje složky σ* vazeb P-Cl. Tyto popisy neuvažují roli orbitalů d.
![]()
- kde pm jsou pikometry
Chemické vlastnosti
POCl3 reaguje s vodou a s alkoholy za vzniku chlorovodíku a kyseliny fosforečné, resp. jejích esterů:
- O=PCl3 + 3 H2O → O=P(OH)3 + 3 HCl
Pokud se voda nahradí alkoholem, vznikne trialkylfosfát. Takové reakce často probíhají za přítomnosti akceptoru HCl, například pyridinu nebo aminu. Pokud se POCl3 zahřívá v nadbytku fenolů za přítomnosti Lewisovy kyseliny (například chloridu hořečnatého) jako katalyzátoru, vznikají triarylfosfáty, například trifenylfosfát:
- 3 C6H5OH + O=PCl3 → O=P(OC6H5)3 + 3 HCl
POCl3 může také působit jako Lewisova zásada a tvořit adukty s různými Lewisovými kyselinami, kupříkladu chloridem titaničitým:
- Cl3P+-O− + TiCl4 → Cl3P+-O−-TiCl4
Adukt s chloridem hlinitým (POCl3·AlCl3) je poměrně stabilní a POCl3 lze proto použít k úplnému odstranění AlCl3 z reakčních směsí na konci Friedelových–Craftsových reakcí. S bromovodíkem POCl3 reaguje v přítomnosti AlCl3 za vzniku tribromidu fosforylu POBr3.
Příprava
Trichlorid fosforylu lze připravovat reakcí chloridu fosforitého s kyslíkem (vzduch je neúčinný) při 20–50 °C:
- 2 PCl3 + O2 → 2 O=PCl3
Alternativní syntéza je založena na reakci chloridu fosforečného a oxidu fosforečného. Protože se jedná o tuhé látky, obvyklou cestou provádění této reakce je chlorace směsi PCl3 a P4O10, která generuje PCl5 in situ. Jak se spotřebovává PCl3, stává se reakčním rozpouštědlem POCl3.
- 6 PCl3 + 6 Cl2 → 6 PCl5
- 6 PCl5 + P4O10 → 10 POCl3
Chlorid fosforečný tvoří POCl3 také při reakci s vodou, ale tato reakce se hůře ovládá než ty výše uvedené.
Použití
Nejvýznamnějším použitím trichloridu fosforylu je výroba triarylfosfátů (viz výše), například trifenylfosfátu a trikresylfosfátu. Tyto estery se mnoho let používají jako zpomalovače hoření a plastifikátory do PVC. Trialkylestery, například tributylfosfát (vyrábí se podobným způsobem z butan-1-olu) se používají jako extrakční rozpouštědla v přepracovávání jaderného odpadu i jinde.
V průmyslu polovodičů se POCl3 používá jako bezpečný kapalný zdroj fosforu v difuzních procesech. Fosfor zde vystujuje jako dopant pro výrobu polovodičových vrstev typu N.
V laboratoři se POCl3 široce používá jako dehydratační činidlo, například při konverzi amidů na nitrily. Podobně lze některé arylamidy cyklizovat na dihydroisochinolinové deriváty pomocí Bischlerovy–Napieralského reakce.
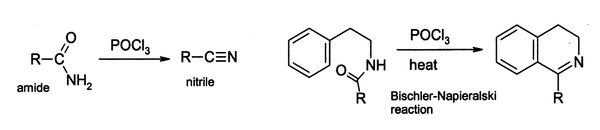
Některé reakce zřejmě probíhají přes imidoylchlorid. V některých případech, kde je imidoylchlorid stabilní, je konečným produktem. Například pyridony a pyrimidony lze převádět na chlorderiváty pyridinů a pyrimidinů, které jsou důležitými surovinami pro farmaceutický průmysl.[2]
Reference
V tomto článku byl použit překlad textu z článku Phosphoryl chloride na anglické Wikipedii.
- ↑ a b Phosphorus oxychloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ R. C. Elderfield, Heterocyclic Compounds, Vol. 6, p 265
Literatura
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- A. D. F. Toy, The Chemistry of Phosphorus, Pergamon Press, Oxford, UK, 1973.
- L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 477, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
- B. J. Walker, Organophosphorus chemistry, p. 101–116, Penguin, Harmondsworth, UK, 1972.
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy