|
Правило Гюккеля
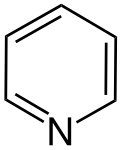
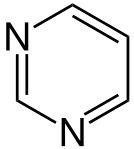
Правило Гюккеля (англ. Hückel's rule) — спосіб оцінки наявності ароматичних властивостей у циклічних органічних молекулах із циклічно кон'югованими π-зв'язками. Квантово-механічну основу для цього правила розробив німецький хімік Еріх Гюккель у 1931 році (див. метод Гюккеля)[1][2]. ПравилоМоноциклічна плоска (або майже плоска) сполука, що має циклічно кон'югованих π-електронів (n = 0, 1, 2,..), має високу стабільність і називається ароматичною[3]. Відповідно, плоска молекула з циклічно кон'югованими π-електронів є нестабільною й називається антиароматичною. Теоретично, n може дорівнювати нулю або будь-якому цілому числу більше нуля, але практичні приклади відомі лише для значень n = 0 до приблизно n = 6[4]. Ілюстрацією правила Гюккеля є цикл Фроста. ПрикладиАнулениКласичними сполуками, на прикладі яких демонструється правило Гюккеля, є анулени. Нижче представлені приклади ануленів та їх відповідність до правила Гюккеля (n = 1 — 4)[5]:  Найважливішим прикладом ароматичної сполуки є бензен, який має 6 π-електронів (n = 1). Гетероароматичні сполукиГетероциклічні сполуки, що відповідають правилу Гюккеля, теж мають певні ароматичні властивості. При цьому слід поділяти між п'ятичленними й шестичленними гетероароматами. У випадку п'ятичленних гетероароматів (напр., пірол, фуран, тіофен) делокалізація π-електронів реалізується за участі орбіталі гетероатома з вільною електронною парою; ця електронна пара також бере участь в делокалізації, тому також рахується згідно з правилом . У шестичленних гетероароматах (піридин, піримідин) гетероатом (у нейтральних гетероароматах це, зазвичай, Нітроген) утворює три зв'язки з атомами циклу, а його вільна електронна пара не бере участь у делокалізації. Заряджені молекулиАроматичні або антиароматичні властивості можуть проявляти не лише нейтральні молекули, але й іони циклічних полієнів; при цьому циклічна делокалізація реалізується за рахунок пустих p-орбіталей (у випадку карбокатіону) або p-орбіталей з вільною електронною парою (у випадку карбаніону). Тобто, вільні електронні пари також беруть участь в делокалізації, тому рахуються разом з π-електронами. Вільні p-орбіталі в карбокатіонах, таким чином, надають 0 електронів до делокалізації. Найпростішим ароматичним іоном є циклопропеніл-катіон, що містить 2 π-електрони (n = 0):  Наступним у цьому списку йде циклопентадієніл-аніон (Cp-) (Cyclopentadienyl_anion[en]), що має 6 делокалізованих π-електронів. Тропілій-катіон, до речі, теж має 6 π-електронів, але є семичленним циклом. Наступним ароматичним іоном є циклооктатетраєнід-діаніон (en1[en], en2), що має 10 π-електронів:
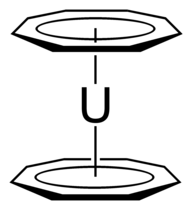
 Також відомі випадки гетероароматичних іонів, наприклад пірилій-катіон. Звісно, ароматичні іони, хоч і вважаються ароматичними, є доволі реактивними, хоча тропілій-катіон можна кристалізувати разом із деякими аніонами (наприклад, бромід, йодид, перхлорат, тетрафлуороборат)[6][7][8]. Тим не менш, звичною сферою застосування ароматичних іонів є металоорганічна хімія, де ці іони використовуються в якості лігандів у металоценах:
Обмеження й недоліки методуПравило Гюкеля добре працює для моноциклічних сполук[9], але є неточним у випадку конденсованих поліциклічних ароматів. Наприклад, нафталін та антрацен мають 10 та 14 π-електронів, а от ароматичні пірен (16 π-електронів) і коронен (24 π-електрони) вже не відповідають вимозі «». Альтернативно можна рахувати тільки ті електрони, що є моноциклічно кон'югованими (наприклад, тільки зовнішнє «кільце» коронену, яке має 18 π-електронів), але такий підхід можливий не в усіх випадках. Однак, підхід «лічити тільки моноциклічно кон'юговані π-електрони» є дещо виправданим, що підтверджено теоретичними розрахунками[10].
Див. такожПримітки
Information related to Правило Гюккеля |
||||