| –°—ā—Ä—É–ļ—ā—É—Ä–Ĺ–į —Ą–ĺ—Ä–ľ—É–Ľ–į
|
![]()
|
| –ó–į–≥–į–Ľ—Ć–Ĺ–į —Ė–Ĺ—Ą–ĺ—Ä–ľ–į—Ü—Ė—Ź
|
| –ü—Ä–Ķ—Ą–Ķ—Ä–Ķ–Ĺ—Ü—Ė–Ļ–Ĺ–į –Ĺ–į–∑–≤–į –Ü–ģ–ü–ź–ö
|
–Ę—Ä–ł—Ö–Ľ–ĺ—Ä–ĺ–ľ–Ķ—ā–ł–Ľ–Ī–Ķ–Ĺ–∑–Ķ–Ĺ
|
| –°–ł—Ā—ā–Ķ–ľ–į—ā–ł—á–Ĺ–į –Ĺ–į–∑–≤–į –Ü–ģ–ü–ź–ö
|
–Ę—Ä–ł—Ö–Ľ–ĺ—Ä–ĺ–ľ–Ķ—ā–ł–Ľ–Ī–Ķ–Ĺ–∑–Ķ–Ĺ
|
| –Ü–Ĺ—ą—Ė –Ĺ–į–∑–≤–ł
|
–Ď–Ķ–Ĺ–∑–ĺ—ā—Ä–ł—Ö–Ľ–ĺ—Ä–ł–ī, —ā—Ä–ł—Ö–Ľ–ĺ—Ä–ĺ—ā–ĺ–Ľ—É–Ķ–Ĺ, —Ą–Ķ–Ĺ—Ė–Ľ—Ö–Ľ–ĺ—Ä–ĺ—Ą–ĺ—Ä–ľ
|
| –•—Ė–ľ—Ė—á–Ĺ–į —Ą–ĺ—Ä–ľ—É–Ľ–į
|
C7H5Cl3
|
| 3D –°—ā—Ä—É–ļ—ā—É—Ä–į (JSmol)
|
–Ü–Ĺ—ā–Ķ—Ä–į–ļ—ā–ł–≤–Ĺ–Ķ –∑–ĺ–Ī—Ä–į–∂–Ķ–Ĺ–Ĺ—Ź
–Ü–Ĺ—ā–Ķ—Ä–į–ļ—ā–ł–≤–Ĺ–Ķ –∑–ĺ–Ī—Ä–į–∂–Ķ–Ĺ–Ĺ—Ź
|
| –ó–ĺ–≤–Ĺ—Ė—ą–Ĺ—Ė —Ė–ī–Ķ–Ĺ—ā–ł—Ą—Ė–ļ–į—ā–ĺ—Ä–ł / –Ď–į–∑–ł –ī–į–Ĺ–ł—Ö
|
|
|
| –í–Ľ–į—Ā—ā–ł–≤–ĺ—Ā—ā—Ė
|
| –ú–ĺ–Ľ—Ź—Ä–Ĺ–į –ľ–į—Ā–į
|
195,48 –≥/–ľ–ĺ–Ľ—Ć [1][2]
|
| –ź–≥—Ä–Ķ–≥–į—ā–Ĺ–ł–Ļ —Ā—ā–į–Ĺ
|
–†—Ė–ī–ł–Ĺ–į
|
| –ď—É—Ā—ā–ł–Ĺ–į
|
1,37 –≥/—Ā–ľ3 (20 ¬įC) [2]
|
| –Ę–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–į –Ņ–Ľ–į–≤–Ľ–Ķ–Ĺ–Ĺ—Ź
|
-7.5 ¬įC[1] ‚ÄĒ -4,5 ¬įC[2]
|
| –Ę–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–į –ļ–ł–Ņ—Ė–Ĺ–Ĺ—Ź
|
220,7 ¬įC[2]
|
| –Ę–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–į —Ā–į–ľ–ĺ–∑–į–Ļ–ľ–į–Ĺ–Ĺ—Ź
|
420 ¬įC[2] ‚ÄĒ 445 ¬įC[1]
|
| –Ď–Ķ–∑–Ņ–Ķ–ļ–į
|
| –ú–į—Ä–ļ—É–≤–į–Ĺ–Ĺ—Ź –∑–≥—Ė–ī–Ĺ–ĺ —Ā–ł—Ā—ā–Ķ–ľ—Ė –£–ď–°



–Ě–Ķ–Ī–Ķ–∑–Ņ–Ķ–ļ–į
|
| H-—Ą—Ä–į–∑–ł
|
H: H302, H330, H315, H317, H318, H335, H350
|
| P-—Ą—Ä–į–∑–ł
|
P: P202, P280, P302+P352, P304+P340, P305+P351+P338, P310
|
| EUH-—Ą—Ä–į–∑–ł
|
EUH: –ó–į—Ö–ĺ–ī–ł –Ī–Ķ–∑–Ņ–Ķ–ļ–ł –≤—Ė–ī—Ā—É—ā–Ĺ—Ė
|
| LD50
|
1590 –ľ–≥/–ļ–≥ (–ĺ—Ä–į–Ľ—Ć–Ĺ–ĺ, –Ņ–į—Ü—é–ļ)
|
|
|
|
| –í–ł–Ī—É—Ö–ĺ–Ĺ–Ķ–Ī–Ķ–∑–Ņ–Ķ—á–Ĺ—Ė—Ā—ā—Ć
|
| –Ě–į—Ā–ļ—Ė–Ľ—Ć–ļ–ł —Ü–Ķ –ľ–ĺ–∂–Ľ–ł–≤–ĺ, –∑–Ĺ–į—á–Ķ–Ĺ–Ĺ—Ź –≤–Ķ–Ľ–ł—á–ł–Ĺ –Ņ–ĺ–ī–į–Ĺ—Ė –≤ –ĺ–ī–ł–Ĺ–ł—Ü—Ź—Ö —Ā–ł—Ā—ā–Ķ–ľ–ł SI. –Į–ļ—Č–ĺ –Ĺ–Ķ –≤–ļ–į–∑–į–Ĺ–ĺ —Ė–Ĺ—ą–ĺ–≥–ĺ, —É—Ā—Ė –ī–į–Ĺ—Ė –≤—Ė–ī–Ĺ–ĺ—Ā—Ź—ā—Ć—Ā—Ź –ī–ĺ —Ā—ā–į–Ĺ–ī–į—Ä—ā–Ĺ–ĺ–≥–ĺ —Ā—ā–į–Ĺ—É.
|
–Ď–Ķ–Ĺ–∑–łŐĀ–Ľ—ā—Ä–ł—Ö–Ľ–ĺ—Ä–łŐĀ–ī ‚Äē —Ö–Ľ–ĺ—Ä–ĺ–ĺ—Ä–≥–į–Ĺ—Ė—á–Ĺ–į —Ā–Ņ–ĺ–Ľ—É–ļ–į –∑ —Ą–ĺ—Ä–ľ—É–Ľ–ĺ—é  . –ó–į —Ā—ā–į–Ĺ–ī–į—Ä—ā–Ĺ–ł—Ö —É–ľ–ĺ–≤ —Ē –Ī–Ķ–∑–Ī–į—Ä–≤–Ĺ–ĺ—é —Ä—Ė–ī–ł–Ĺ–ĺ—é –∑ —Ä—Ė–∑–ļ–ł–ľ –∑–į–Ņ–į—Ö–ĺ–ľ. –†–ĺ–∑—á–ł–Ĺ—Ź—Ē—ā—Ć—Ā—Ź –≤ –ĺ—Ä–≥–į–Ĺ—Ė—á–Ĺ–ł—Ö —Ä–ĺ–∑—á–ł–Ĺ–Ĺ–ł–ļ–į—Ö, —É –≤–ĺ–ī—Ė –≥—Ė–ī—Ä–ĺ–Ľ—Ė–∑—É—Ē—ā—Ć—Ā—Ź.[1][2]
. –ó–į —Ā—ā–į–Ĺ–ī–į—Ä—ā–Ĺ–ł—Ö —É–ľ–ĺ–≤ —Ē –Ī–Ķ–∑–Ī–į—Ä–≤–Ĺ–ĺ—é —Ä—Ė–ī–ł–Ĺ–ĺ—é –∑ —Ä—Ė–∑–ļ–ł–ľ –∑–į–Ņ–į—Ö–ĺ–ľ. –†–ĺ–∑—á–ł–Ĺ—Ź—Ē—ā—Ć—Ā—Ź –≤ –ĺ—Ä–≥–į–Ĺ—Ė—á–Ĺ–ł—Ö —Ä–ĺ–∑—á–ł–Ĺ–Ĺ–ł–ļ–į—Ö, —É –≤–ĺ–ī—Ė –≥—Ė–ī—Ä–ĺ–Ľ—Ė–∑—É—Ē—ā—Ć—Ā—Ź.[1][2]
–ě—ā—Ä–ł–ľ–į–Ĺ–Ĺ—Ź
–ó–į–∑–≤–ł—á–į–Ļ –Ī–Ķ–Ĺ–∑–ł–Ľ—ā—Ä–ł—Ö–Ľ–ĺ—Ä–ł–ī —Ā–ł–Ĺ—ā–Ķ–∑—É—é—ā—Ć —Ö–Ľ–ĺ—Ä—É–≤–į–Ĺ–Ĺ—Ź–ľ —ā–ĺ–Ľ—É–Ķ–Ĺ—É:[2]
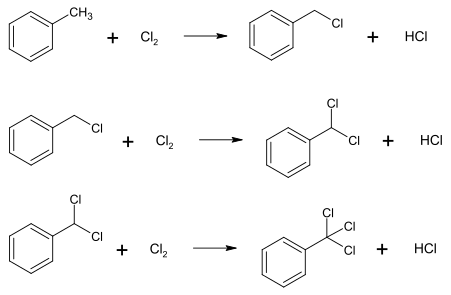
–Ę–į–ļ–ĺ–∂ –ľ–ĺ–∂–Ľ–ł–≤–Ķ —Ö–Ľ–ĺ—Ä—É–≤–į–Ĺ–Ĺ—Ź –ī–ł–Ī–Ķ–Ĺ–∑–ł–Ľ–ĺ–≤–ĺ–≥–ĺ –Ķ—ā–Ķ—Ä—É, —Č–ĺ –ī–į—Ē —Ā—É–ľ—Ė—ą –Ī–Ķ–Ĺ–∑–ĺ—ó–Ľ—Ö–Ľ–ĺ—Ä–ł–ī—É —ā–į –Ī–Ķ–Ĺ–∑–ĺ—ā—Ä–ł—Ö–Ľ–ĺ—Ä–ł–ī—É.[2]
–•—Ė–ľ—Ė—á–Ĺ—Ė –≤–Ľ–į—Ā—ā–ł–≤–ĺ—Ā—ā—Ė
–ó–į–ľ—Ė—Č–Ķ–Ĺ–Ĺ—Ź —Ö–Ľ–ĺ—Ä—É
–£ –≤–ĺ–ī—Ė –≥—Ė–ī—Ä–ĺ–Ľ—Ė–∑—É—Ē—ā—Ć—Ā—Ź, –Ņ—Ä–ł —Ü—Ć–ĺ–ľ—É —É—ā–≤–ĺ—Ä—é—Ē—ā—Ć—Ā—Ź –į–Ī–ĺ –Ī–Ķ–Ĺ–∑–ĺ–Ļ–Ĺ–į –ļ–ł—Ā–Ľ–ĺ—ā–į, –į–Ī–ĺ –Ī–Ķ–Ĺ–∑–ĺ—ó–Ľ—Ö–Ľ–ĺ—Ä–ł–ī (–Ĺ–Ķ–Ņ–ĺ–≤–Ĺ–ł–Ļ –≥—Ė–ī—Ä–ĺ–Ľ—Ė–∑), –∑–į 2,4 —Ö–≤–ł–Ľ–ł–Ĺ–ł –≥—Ė–ī—Ä–ĺ–Ľ—Ė–∑—É—Ē—ā—Ć—Ā—Ź –Ņ–ĺ–Ľ–ĺ–≤–ł–Ĺ–į —Ä–Ķ—á–ĺ–≤–ł–Ĺ–ł:[2][3]

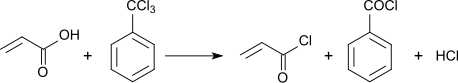
–ü—Ä–ł —Ä–Ķ–į–ļ—Ü—Ė—ó –∑—Ė —Ā–Ņ–ł—Ä—ā–į–ľ–ł —É—ā–≤–ĺ—Ä—é—é—ā—Ć—Ā—Ź –ĺ—Ä—ā–ĺ–Ķ—Ā—ā–Ķ—Ä–ł –Ī–Ķ–Ĺ–∑–ĺ–Ļ–Ĺ–ĺ—ó –ļ–ł—Ā–Ľ–ĺ—ā–ł:[2]

–ü—Ä–ł –≤–∑–į—Ē–ľ–ĺ–ī—Ė—ó –∑ —Ą–Ľ—É–ĺ—Ä–ł–ī–Ĺ–ĺ—é –ļ–ł—Ā–Ľ–ĺ—ā–ĺ—é —á–ł —ó—ó —Ā–ĺ–Ľ—Ź–ľ–ł –≤—Ā—Ė –į—ā–ĺ–ľ–ł —Ö–Ľ–ĺ—Ä—É –∑–į–ľ—Ė—Č—É—Ē—ā—Ć—Ā—Ź –Ĺ–į –į—ā–ĺ–ľ–ł —Ą–Ľ—É–ĺ—Ä—É, —É—ā–≤–ĺ—Ä—é—é—á–ł –Ī–Ķ–Ĺ–∑–ĺ—ā—Ä–ł—Ą–Ľ—É–ĺ—Ä–ł–ī.[2]
–Ď–Ķ–Ĺ–∑–ĺ—ā—Ä–ł—Ö–Ľ–ĺ—Ä–ł–ī –Ņ–Ķ—Ä–Ķ—ā–≤–ĺ—Ä—é—Ē –ļ–į—Ä–Ī–ĺ–Ĺ–ĺ–≤—Ė –ļ–ł—Ā–Ľ–ĺ—ā–ł –Ĺ–į —Ö–Ľ–ĺ—Ä–ĺ–į–Ĺ–≥—Ė–ī—Ä–ł–ī–ł —Ü–ł—Ö –ļ–ł—Ā–Ľ–ĺ—ā, –≥—Ė–ī—Ä–ĺ–Ľ—Ė–∑—É—é—á–ł—Ā—Ć –ī–ĺ –Ī–Ķ–Ĺ–∑–ĺ—ó–Ľ—Ö–Ľ–ĺ—Ä–ł–ī—É:[2]
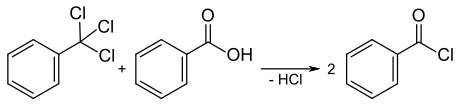
–Ę–ĺ–ļ–ł—Ā—á–Ĺ—Ė—Ā—ā—Ć
–Ď–Ķ–Ĺ–∑–ĺ—ā—Ä–ł—Ö–Ľ–ĺ—Ä–ł–ī —Ē —ā–ĺ–ļ—Ā–ł—á–Ĺ–ĺ—é —Ā–Ņ–ĺ–Ľ—É–ļ–ĺ—é: –Ņ–ĺ–ī—Ä–į–∑–Ĺ—é—Ē –ĺ—á—Ė, —ą–ļ—Ė—Ä—É, –ī–ł—Ö–į–Ľ—Ć–Ĺ—É —Ā–ł—Ā—ā–Ķ–ľ—É, –į —ā–į–ļ–ĺ–∂ —Ē –ľ—É—ā–į–≥–Ķ–Ĺ–ĺ–ľ —Ė –ļ–į–Ĺ—Ü–Ķ—Ä–ĺ–≥–Ķ–Ĺ–ĺ–ľ.[1]
–ü—Ä–ł–ľ—Ė—ā–ļ–ł