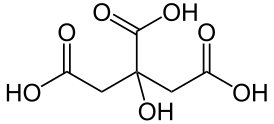
Лимонная кислота
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

Burung-madu pengantin Status konservasi Risiko Rendah Klasifikasi ilmiah Kerajaan: Animalia Filum: Chordata Kelas: Aves Ordo: Passeriformes Famili: Nectariniidae Genus: Nectarinia Spesies: N. sperata Nama binomial Nectarinia sperataLinnaeus, 1766 Sinonim Certhia sperata (Linnaeus, 1766) Nectarinia sperata (Linnaeus, 1766) Burung-madu pengantin (Leptocoma sperata) adalah spesies burung berukuran kecil dari keluarga Nectariniidae, dari genus Nectarinia. Burung-madu pengatin memi...

Artikel ini sebatang kara, artinya tidak ada artikel lain yang memiliki pranala balik ke halaman ini.Bantulah menambah pranala ke artikel ini dari artikel yang berhubungan atau coba peralatan pencari pranala.Tag ini diberikan pada November 2022. Sumber referensi dari artikel ini belum dipastikan dan mungkin isinya tidak benar. Mohon periksa, kembangkan artikel ini, dan tambahkan sumber yang benar pada bagian yang diperlukan. (Pelajari cara dan kapan saatnya untuk menghapus pesan templat ini)G...

Canadian-American feminist media critic Anita SarkeesianSarkeesian in 2011Born1983 (age 40–41)[1]NationalityCanadian-American[2]Alma mater California State University, Northridge (BA) York University (MA) Occupations Media critic public speaker Websitewww.anitasarkeesian.com Anita Sarkeesian (/sɑːrˈkiːziən/ sar-KEE-zee-ən; born 1983) is a Canadian-American feminist media critic. She is the founder of Feminist Frequency, a website that hosts videos and com...

Bagian dari seri tentangMuhammad Kehidupan dan karierKehidupan di Mekkah • Hijrah • Muhammad di Madinah • Haji Wada' • Pernikahan • Wafat Karier Wahyu pertama Karier militer Karier diplomatik Pembebasan Mekkah Hadis Mukjizat Al-Quran Isra Mikraj Pembelahan bulan Mukjizat Muhammad PewarisPerpisahan Khotbah • hadits terakhir • Hadits • Ghadir Khum • Saqifah • Ahlul Bait • Sahabat • Khulafaur Rasyidin • Imam • Sejarah Islam Pujian Selawat Maulid Terkait Masjid Nabawi ...

Pour les articles homonymes, voir Schiller. Friedrich Schiller Portrait de Schiller (publié vers 1905). Données clés Nom de naissance Johann Christoph Friedrich Schiller Naissance 10 novembre 1759 Marbach am Neckar Duché de Wurtemberg Décès 9 mai 1805 (à 45 ans) Weimar, Duché de Saxe-Weimar Activité principale Poète, dramaturge et écrivain Auteur Langue d’écriture allemand Mouvement Sturm und Drang, classicisme de Weimar Genres essai, poésie, théâtre, roman Œuvres prin...

Panneau signalant l'entrée du parc national de la vallée de la Mort, le plus étendu des États-Unis contigus. Les parcs nationaux des États-Unis, au nombre de 63, sont gérés par le National Park Service (NPS), une agence du département de l'Intérieur des États-Unis[1]. Les parcs nationaux sont établis par décision du Congrès des États-Unis. Le premier parc national en date, Yellowstone, fut créé en 1872, par un décret signé du président Ulysses S. Grant ; suivirent la c...

Satellite This article has multiple issues. Please help improve it or discuss these issues on the talk page. (Learn how and when to remove these template messages) This article needs to be updated. Please help update this article to reflect recent events or newly available information. (February 2019) This article relies largely or entirely on a single source. Relevant discussion may be found on the talk page. Please help improve this article by introducing citations to additional sources.Fin...

Последний кандидатангл. Designated Survivor Жанры политический триллерполитическая драма Создатель Дэвид Гуггенхайм В главных ролях Кифер СазерлендНаташа МакэлхонМэгги КьюАдан КантоИталия РиччиЛамоника ГарреттТаннер БьюкененКэл Пенн Композитор Шон Коллери[d] Страна С�...

Single by Peter Nieto and Ivy Queen Pa' MíSingle by Peter Nieto and Ivy QueenReleasedApril 22, 2022Recordedin MiamiGenreSalsaLength3:50LabelDiamond MusicSongwriter(s)Peter Nieto, Martha PesanteProducer(s)Jay LugoPeter Nieto and Ivy Queen singles chronology Camuflash (2021) Pa' Mí (2022) Quien Dijo (2022) Pa' Mí is a song by Cuban recording artist Peter Nieto and Puerto Rican recording artist Ivy Queen. The song was written by Queen and Nieto and released as a stand-alone single on April 22...

Autonomous car technology company Waymo LLCCompany typeSubsidiaryIndustryAutonomous carsPredecessorGoogle Self-Driving Car ProjectFoundedJanuary 17, 2009; 15 years ago (January 17, 2009) (as the Google Self-Driving Car Project)December 13, 2016; 7 years ago (2016-12-13) (as Waymo)2004; 20 years ago (2004) (as Stanford Self-Driving Car Team)Founder Sebastian Thrun Anthony Levandowski HeadquartersMountain View, California, U.S.Area served Phoenix...

Perang modern adalah perang yang sangat berbeda dengan konsep, metode, dan teknologi militer sebelumnya, menekankan bagaimana kombatan harus dimodernisasi untuk menjaga kelayakan pertempuran mereka.[1] Karena itu, perang modern adalah subjek yang berkembang, terlihat berbeda di waktu dan tempat yang berbeda. Dalam arti sempitnya, perang modern hanyalah sinonim dari perang kontemporer. Dalam arti luasnya, perang modern mencakup semua peperangan sejak revolusi bubuk mesiu yang menandai ...

Miami-Dade Transit metro station This article has multiple issues. Please help improve it or discuss these issues on the talk page. (Learn how and when to remove these template messages) This article needs to be updated. Please help update this article to reflect recent events or newly available information. (August 2016) This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and ...

Insoluble protein aggregate with a fibrillar morphology For other uses, see Amyloid (disambiguation). Micrograph showing amyloid deposits (pink) in small bowel. Duodenum with amyloid deposition in lamina propria. Amyloid shows up as homogeneous pink material in lamina propria and around blood vessels. 20× magnification. Amyloids are aggregates of proteins characterised by a fibrillar morphology of typically 7–13 nm in diameter, a β-sheet secondary structure (known as cross-β) and ability...

USA-related events during the year of 2017 ← 2016 2015 2014 2017 in the United States → 2018 2019 2020 Decades: 1990s 2000s 2010s 2020s 2030s See also: History of the United States (2008–present) Timeline of United States history (2010–present) List of years in the United States 2017 in the United States2017 in U.S. states and territories States Alabama Alaska Arizona Arkansas California Colorado Connecticut Delaware Florida Georgia Hawaii Idaho Illinois Indiana Iowa Kansas Ke...

Daftar berikut ini menampilkan konser solo dari anggota Big Bang G-Dragon Shine a Light Shine a LightTur oleh G-DragonLokasiKorea SelatanHeartbreakerMulai5 Desember 2009Berakhir6 Desember 2009Penampilan2 pertunjukkanKronologi konser G-Dragon Shine a Light(2009) G-Dragon 2013 World Tour: One of a Kind(2013) Shine a Light adalah konser pertama dari G-Dragon yang digelar untuk mendukung album pertamanya, Heartbreaker. Sambutan Konser ini memicu kontroversi menyusul adanya keluhan bersifat cabul&...

جيرلانStade de Gerland (بالفرنسية) معلومات عامةالعنوان 350 Avenue Jean-Jaures, F-69007 Lyon (بالإنجليزية)[1]353 avenue Jean Jaures 69007 Lyon 07 (بالفرنسية)[2] المنطقة الإدارية 7th arrondissement of Lyon (en) [3][4] البلد فرنسا[3][4][2] موقع الويب gl-events.com… (الفرنسية، الإنجليزية) التشييد والافتتاحبد�...

Эта статья о дате; о леворадикальной террористической организации см. Революционная организация 17 ноября. ←→Ноябрь Пн Вт Ср Чт Пт Сб Вс 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 2024 год Содержание 1 Праздники и памятные дни 1.1 Международные 1.2 Национа�...

Eksterior Kapel Sedlec Ossuary (Ceko: kostnice Sedlec) adalah kapel Katolik Roma kecil di Sedlec, suburban Kutná Hora di Ceko. Ossuary ini terdiri dari kira-kira 40.000-70.000 tulang manusia yang telah disusuk untuk membentuk dekorasi kapel. Pranala luar Wikimedia Commons memiliki media mengenai Sedlec Ossuary. Official website (cz, en, de) 360 VR Panorama of Sedlec Ossuary Diarsipkan 2008-03-12 di Wayback Machine. from Prague 360 Video of the ossuary at traveller, Tom Grundy's, personal tra...

Ne doit pas être confondu avec Anomie. Pour les articles homonymes, voir Anarchie (homonymie). Article connexe : Anarchisme. Le « A » cerclé, dans deux styles différents, symbole[1] de l'anarchisme, indépendamment du courant concerné. Représentation des différentes phases de la révolution ouvrière avant l’avènement de l'anarchie - affiche de la CNT, 1930 L’anarchie, ou société libertaire, est une société fondée sur la démocratie directe sans système de p...

1931 film This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Laughing Gravy – news · newspapers · books · scholar · JSTOR (March 2013) (Learn how and when to remove this message) Laughing GravyDirected byJames W. HorneWritten byH. M. WalkerStan Laurel (uncredited)Produced byHal RoachStarringStan LaurelOliver Ha...