|
Tlenek osmu(VIII)
Tlenek osmu(VIII)
|
|

Próbka OsO
4 w ampułce
|
|
|
| Ogólne informacje
|
| Wzór sumaryczny
|
OsO
4
|
| Masa molowa
|
254,23 g/mol
|
| Wygląd
|
białe, błyszczące kryształy[1] o nieprzyjemnym zapachu[2]
|
| Identyfikacja
|
| Numer CAS
|
20816-12-0
|
| PubChem
|
30318
|
| InChI
|
InChI=1S/4O.Os
|
| InChIKey
|
VUVGYHUDAICLFK-UHFFFAOYSA-N
|
|
|
|
| Niebezpieczeństwa
|
| Karta charakterystyki: dane zewnętrzne firmy Sigma-Aldrich [dostęp 2019-05-28]
|
|
|
Globalnie zharmonizowany system
klasyfikacji i oznakowania chemikaliów
|
| Na podstawie podanej karty charakterystyki
|
|
|
|
|
| Zwroty H
|
H300, H310, H314, H330, H334
|
| Zwroty P
|
P260, P264, P280, P284, P301+P310, P302+P350
|
|
|
| Numer RTECS
|
RN1140000
|
| Dawka śmiertelna
|
LD50 162 mg/kg (mysz, doustnie)[3]
|
|
| Podobne związki
|
| Podobne związki
|
tlenek rutenu(VIII)
|
Jeżeli nie podano inaczej, dane dotyczą
stanu standardowego (25 °C, 1000 hPa)
|
|
|
Tlenek osmu(VIII), OsO
4 – nieorganiczny związek chemiczny z grupy tlenków, w którym osm występuje na VIII stopniu utlenienia. Jest półproduktem w otrzymywaniu osmu z rud, a w chemii organicznej stosowany jest jako utleniacz w dihydroksylacji olefin.
Otrzymywanie
Otrzymać go można kilkoma metodami:
- utlenianie wodnych roztworów związków osmu, np. osmianu sodu, Na
2OsO
4, za pomocą stężonego kwasu azotowego, a następnie wydzielenie lotnego OsO
4 przez destylację (metoda przemysłowa)[3];
- utlenianie chlorku osmu(IV), OsCl
4, za pomocą roztworu podchlorynu sodu[3];
- ogrzewanie rozdrobnionego osmu metalicznego w tlenie w temperaturze 300–400 °C[3]. Metoda ta jest najbardziej użyteczna w warunkach laboratoryjnych. Powstający gazowy OsO
4 ulega kondensacji w schłodzonej części aparatury, tworząc białe, błyszczące kryształy[1].
Właściwości
Tlenek osmu(VIII) jest białym lub żółtawym krystalicznym ciałem stałym[1] o niskiej temperaturze topnienia (40,6 °C) i wrzenia (129,7 °C). Rozpuszcza się w wodzie (bez rozkładu[1]) i w większości rozpuszczalników organicznych[3]. Można przeprowadzać go w stan gazowy w warunkach destylacji z parą wodną[1]. Jest silnie trujący w każdej formie po dostaniu się do organizmu[3]. Ma nieprzyjemny[2] zapach przypominający chlor[4]. Jest odporny na działanie światła i może być przechowywany bez ograniczeń w naczyniach z bezbarwnego szkła[1]. Jest też stabilny termicznie, dopiero w temperaturze powyżej 800 °C ulega rozkładowi do OsO
3; natomiast ogrzewany z metalicznym osmem daje OsO
2[3].
Ulega redukcji wodorem, na zimno do OsO
2, na gorąco do wolnego osmu[5].
Reaguje ze stężonym kwasem solnym z wydzieleniem chloru[1]. Z wodorotlenkami potasowców daje sole o wzorze Me
2OsO
4(OH)
2 oraz – w przypadku RbOH i CsOH – MeOsO
4(OH) i in. Reaguje też z fluorkami, tworząc jony [OsO
4F
2]2−
, a z amoniakiem wobec alkaliów daje anion [N≡OsO
3]−
. Z licznymi związkami organicznymi tworzy rozmaite związki kompleksowe[3].
Zastosowanie
Otrzymywanie osmu
Tlenek osmu(VIII) jest półproduktem w otrzymywaniu osmu z minerałów zawierających inne platynowce, zwłaszcza do oddzielania soli osmu od związków rutenu. Wykorzystuje się tu fakt, że w wyniku utleniania kwasem azotowym roztworów OsVI
powstaje lotny OsO
4, podczas gdy jony Ru^{VI} dają kompleksy z kwasem azotowym. Po oddestylowaniu OsO
4 rozpuszcza się go w wodnym roztworze NaOH z dodatkiem etanolu i dodaje chlorek amonu. Prowadzi to wytrącenia się kompleksu OsO
2(NH
3)
4Cl
2, który redukuje się wodorem do metalicznego osmu[3].
Dihydroksylacja
W chemii organicznej stosowany jest do dihydroksylacji wiązania podwójnego C=C z wytworzeniem dioli wicynalnych, C(OH)−C(OH)[3]:
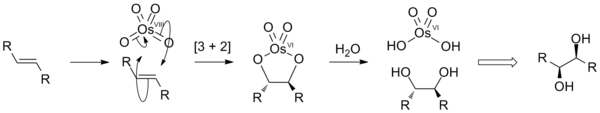
Pierwszym etapem reakcji jest cykloaddycja [3+2] prowadząca do cyklicznego diestru osmianowego(VI)[a], który ulega następnie hydrolizie, np. za pomocą roztworu Na
2SO
3 do diolu[7]. Zamiast OsO
4 w reakcji tej można stosować nadmanganian potasu, KMnO
4, który jest tańszy i bezpieczniejszy, jednak wydajności produktów są niższe. Mechanizm procesu jest analogiczny[8].
Reakcję tę prowadzi się zwykle wobec dodatkowych utleniaczy, np. K
3Fe(CN)
6, dzięki czemu drogi i trujący OsO
4 jest regenerowany w mieszaninie reakcyjnej i można używać go w ilościach katalitycznych[9][10]. W obecności chiralnych ligandów reakcja ta przebiega stereoselektywnie, umożliwiając otrzymywanie dioli chiralnych o określonej konfiguracji[11]. Reakcja ta znana jest jako asymetryczna dihydroksylacja Sharplessa[12]:

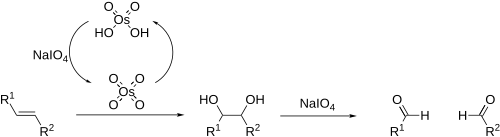
Jeżeli dihydroksylację prowadzi się w obecności nadjodanu sodu, pełni on rolę utleniacza odtwarzającego OsO
4, a jednocześnie powoduje rozerwanie wiązania C(OH)−C(OH). W efekcie olefina przekształcana jest w dwie cząsteczki aldehydów (utlenianie Lemieux-Johnsona)[13][14]:
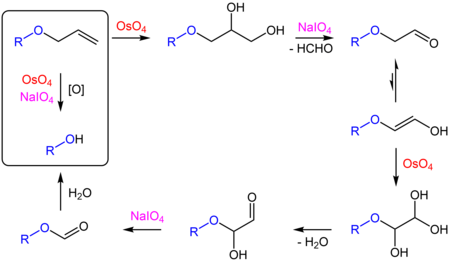
Reakcję tę wykorzystuje się do usuwania allilowych grup ochronnych alkoholi (RO−CH
2−CH=CH
2 → ROH) i amin (RNH−CH
2−CH=CH
2 → RNH
2). Mechanizm reakcji jest następujący[15]:
Mikroskopia
Tlenek osmu(VIII) jest też stosowany w mikroskopii do utrwalania i barwienia preparatów biologicznych[3].
Uwagi
- ↑ Inny możliwy mechanizm powstawania diestru osmianowego to cykloaddycja [2+2], w wyniku której powstaje tylko jedno wiązanie estrowe C−O−Os, natomiast drugi atom węgla łączy się bezpośrednio z atomem osmu wiązaniem C−Os. Czteroczłonowy produkt cykliczny ulega następnie przegrupowaniu do pięcioczłonowego diestru[6].
Przypisy
- ↑ a b c d e f g H.L.H.L. Grube H.L.H.L., Osmium (VIII) Oxide, [w:] GeorgG. Brauer (red.), Handbook of Preparative Inorganic Chemistry, t. 2, New York–London: Academic Press, 1965, s. 1603–1604 .
- ↑ a b Tetratlenek osmu (nr O5500) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2019-05-28]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c d e f g h i j k l m n o p q r Osmium tetroxide, [w:] PradyotP. Patnaik PradyotP., Handbook of Inorganic Chemicals, London: McGraw-Hill, 2003, s. 671–674, ISBN 0-07-049439-8 (ang.).
- ↑ Osmium tetroxide, [w:] PubChem [online], United States National Library of Medicine, CID: 30318 (ang.).
- ↑ H.L.H.L. Grube H.L.H.L., Osmium (IV) Oxide, [w:] GeorgG. Brauer (red.), Handbook of Preparative Inorganic Chemistry, t. 2, New York–London: Academic Press, 1965, s. 1603 .
- ↑ The cis-vic Dihydroxylation of Alkenes: No Oxidative Cleavage, but an Important Prelude, [w:] ReinhardR. Bruckner ReinhardR., Organic Mechanisms. Reactions, Stereochemistry and Synthesis, Berlin–Heidelberg: Springer, 2010, s. 562–563, DOI: 10.1007/978-3-642-03651-4, ISBN 978-3-642-03650-7 (ang.).
- ↑ Joseph M.J.M. Hornback Joseph M.J.M., Organic Chemistry, wyd. 2, Thomson Brooks/Cole, 2006, s. 439, ISBN 0-534-38951-1 (ang.).
- ↑ Kenneth A.K.A. Savin Kenneth A.K.A., Writing Reaction Mechanisms in Organic Chemistry, wyd. 3, Elsevier/Academic Press, 2015, s. 366–367, DOI: 10.1016/C2012-0-07415-7, ISBN 978-0-12-411475-3 (ang.).
- ↑ MakotoM. Minato MakotoM., KeijiK. Yamamoto KeijiK., JiroJ. Tsuji JiroJ., Osmium tetraoxide catalyzed vicinal hydroxylation of higher olefins by using hexacyanoferrate(III) ion as a cooxidant, „Journal of Organic Chemistry”, 55 (2), 1990, s. 766–768, DOI: 10.1021/jo00289a066 (ang.).
- ↑ JavierJ. Gonzalez JavierJ., ChristineCh. Aurigemma ChristineCh., LarryL. Truesdale LarryL., Synthesis of (+)-(1S,2R)- and (−)-(1R,2S)-trans-2-phenylcyclohexanol via Sharpless asymmetric dihydroxylation (AD), „Organic Syntheses”, 79, 2002, s. 93, DOI: 10.15227/orgsyn.079.0093 .
- ↑ Hartmuth C.H.C. Kolb Hartmuth C.H.C., Michael S. VanM.S.V. Nieuwenhze Michael S. VanM.S.V., K. BarryK.B. Sharpless K. BarryK.B., Catalytic Asymmetric Dihydroxylation, „Chemical Reviews”, 94 (8), 1994, s. 2483–2547, DOI: 10.1021/cr00032a009 (ang.).
- ↑ Bradford P.B.P. Mundy Bradford P.B.P., Michael G.M.G. Ellerd Michael G.M.G., Frank G.F.G. Favaloro Frank G.F.G., Name Reactions and Reagents in Organic Synthesis, Hoboken: John Wiley & Sons, 2005, DOI: 10.1002/9780471739876, ISBN 978-0-471-73987-6 (ang.). Brak numerów stron w książce
- ↑ R.R. Pappo R.R. i inni, Osmium Tetroxide-Catalyzed Periodate Oxidation of Olefinic Bonds, „Journal of Organic Chemistry”, 21 (4), 1956, s. 478–479, DOI: 10.1021/jo01110a606 (ang.).
- ↑ Oxidative Cleavage of Alkenes, [w:] ReinhardR. Bruckner ReinhardR., Organic Mechanisms. Reactions, Stereochemistry and Synthesis, Berlin–Heidelberg: Springer, 2010, s. 566–567, DOI: 10.1007/978-3-642-03651-4, ISBN 978-3-642-03650-7 (ang.).
- ↑ Pavel I.P.I. Kitov Pavel I.P.I., David R.D.R. Bundle David R.D.R., Mild Oxidative One-Pot Allyl Group Cleavage, „Organic Letters”, 3 (18), 2001, s. 2835–2838, DOI: 10.1021/ol016278t (ang.).
|
|