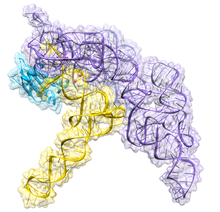
tRNA(黄)と複合体を形成した細菌のRNase Pホロ酵素の結晶構造。触媒に関与する金属イオンが桃色の球で示されている。3Q1R リボヌクレアーゼP (EC 3.1.26.5 、英 : ribonuclease P 、略称: RNase P )は、RNA を切断するリボヌクレアーゼ の1種である。RNase Pは、リボザイム (タンパク質 ベースの酵素 と同様に触媒 として機能するリボ核酸)であるという点で他のリボヌクレアーゼとは異なり独特である。RNase Pの機能は、tRNA 分子から余分な前駆体配列を切除することである[ 1] リボソーム )。RNase Pなどのリボザイムの発見により、シドニー・アルトマン とトーマス・チェック は1989年にノーベル化学賞 を受賞した。1970年代、アルトマンは隣接配列(5'リーダー配列)を持ったtRNA前駆体が存在すること、RNase Pがその配列の除去(プロセシング)を行うことを発見した。また、近年RNase Pの新たな機能も明らかにされている[ 2] 核 内のRNase Pは、tRNA、5S rRNA 、SRP RNA、U6 snRNA など、さまざまな低分子ノンコーディングRNA の正常で効率的な転写 に必要である[ 3] RNAポリメラーゼ のうちの1つであるRNAポリメラーゼIII によって行われる。
細菌 のRNase Pは、M1 RNAと呼ばれるRNA鎖とC5タンパク質と呼ばれるポリペプチド鎖の2つの構成要素からなる[ 4] [ 5] In vivo in vitro [ 1] 同軸的スタッキング をした大きなヘリカルドメインが、tRNA前駆体を形状に基づいて認識していることが示された。この結晶構造は、基質認識と触媒に関する初期のモデルを裏付け、活性部位の位置を特定し、タンパク質構成要素がどのようにRNase Pの機能を向上させているのかを明らかにした[ 6] [ 7]
古細菌 では、RNase PはRNAと4–5個のタンパク質サブユニットからなるリボヌクレオタンパク質 である。In vitro での再構成実験により、tRNAのプロセシングに関しては個々のタンパク質サブユニットは必須ではなく、本質的にはRNA構成要素によって媒介されていることが明らかにされた[ 8] [ 9] [ 10] X線結晶構造解析 とNMR によって解かれており、機能の基礎となる新たなタンパク質ドメイン とそのフォールディング が明らかにされている。
比較ゲノミクス と計算科学的手法の改善により、「タイプT」と呼ばれる極端に最小化されたRNase PのRNAが、ピュロバクルム属 、Caldivirga属、Vulcanisaeta属を含む、クレン古細菌 のテルモプロテウス科のすべての完全ゲノム 中に発見された[ 11] トランス に作用するリボザイムの中で最小のものである[ 11]
近年、Nanoarchaeum equitans プロモーター はtRNA遺伝子に近接して存在し、転写 はtRNAの最初の塩基から開始され、そのためRNase Pによる除去の必要がないと考えられている[ 12]
ヒトや酵母 のような真核生物 では、ほとんどのRNase Pは、細菌のものと構造的に類似したRNA鎖[ 13] [ 2] [ 14] 相同 である。RNaseのタンパク質サブユニットは、核小体 でリボソームRNAのプロセシングに関与する触媒性リボヌクレオタンパク質のRNase MRP と共通である[ 14] [ 15] [ 16] [ 17] [ 18] [ 19] 細胞周期 といった、RNase PやRNase MRPが有する他の生物学的機能には必須のようである[ 3] [ 20]
高等動物や植物のミトコンドリア 、葉緑体 や色素体 は、細菌に起源を有するにもかかわらず、RNAを基盤とするRNase Pを持っていないようである。ヒトのミトコンドリアのRNase Pはタンパク質であり、RNAを含まないことが示されている[ 21] ホウレンソウ の葉緑体のRNase Pに関しても、RNAサブユニットなしで機能することが示されている[ 22]
現在RNase Pは、単純ヘルペスウイルス [ 23] サイトメガロウイルス [ 23] [ 24] インフルエンザ や他の呼吸器感染症 [ 25] ヒト免疫不全ウイルス [ 26] BCR-ABL融合遺伝子 によるがん [ 23] [ 27] mRNA に対し相補的で、tRNAのTループとアクセプターステムを模倣する構造を持つよう設計される[ 25] [ 28]
^ a b “The RNA moiety of ribonuclease P is the catalytic subunit of the enzyme”. Cell 35 (3 Pt 2): 849–57. (1983). doi :10.1016/0092-8674(83)90117-4 . PMID 6197186 .
^ a b “Human RNase P: a tRNA-processing enzyme and transcription factor” . Nucleic Acids Res. 35 (11): 3519–24. (2007). doi :10.1093/nar/gkm071 . PMC 1920233 . PMID 17483522 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1920233/ .
^ a b “A role for the catalytic ribonucleoprotein RNase P in RNA polymerase III transcription” . Genes Dev. 20 (12): 1621–35. (2006). doi :10.1101/gad.386706 . PMC 1482482 . PMID 16778078 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1482482/ .
^ “RNase P: interface of the RNA and protein worlds”. Trends Biochem. Sci. 31 (6): 333–41. (2006). doi :10.1016/j.tibs.2006.04.007 . PMID 16679018 . ^ “Molecular modeling of the three-dimensional structure of the bacterial RNase P holoenzyme” . J. Mol. Biol. 325 (4): 661–75. (2003). doi :10.1016/S0022-2836(02)01267-6 . PMID 12507471 . http://www-ibmc.u-strasbg.fr/upr9002/westhof/PDF/2003_HTsai_JMB.pdf . ^ Reiter N, Osterman A, Torres-Larios A, Swinger KK, Pan T, Mondragon A, Nicholas J.; Osterman, Amy; Torres-Larios, Alfredo; Swinger, Kerren K.; Pan, Tao; Mondragón, Alfonso (2010). “Structure of a bacterial ribonuclease P holoenzyme in complex with tRNA” . Nature 468 (7325): 784–789. doi :10.1038/nature09516 . PMC 3058908 . PMID 21076397 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3058908/ . ^ Masquida B, Westhof E, B.; Westhof, E. (2011). “RNase P: At last, the key finds its lock” . RNA 17 (9): 1615–1618. doi :10.1261/rna.2841511 . PMC 3162327 . PMID 21803972 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3162327/ . ^ “Archaeal RNase P has multiple protein subunits homologous to eukaryotic nuclear RNase P proteins” . RNA 8 (3): 296–306. (2002). doi :10.1017/S1355838202028492 . PMC 1370252 . PMID 12003490 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1370252/ . ^ “A fifth protein subunit Ph1496p elevates the optimum temperature for the ribonuclease P activity from Pyrococcus horikoshii OT3”. Biochem. Biophys. Res. Commun. 343 (3): 956–64. (2006). doi :10.1016/j.bbrc.2006.02.192 . PMID 16574071 . ^ “Functional reconstitution and characterization of Pyrococcus furiosus RNase P” . Proc. Natl. Acad. Sci. U.S.A. 103 (44): 16147–52. (2006). doi :10.1073/pnas.0608000103 . PMC 1637551 . PMID 17053064 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1637551/ . ^ a b “Discovery of a minimal form of RNase P in Pyrobaculum” . Proc. Natl. Acad. Sci. U.S.A. 107 (52): 22493–8. (December 2010). doi :10.1073/pnas.1013969107 . PMC 3012483 . PMID 21135215 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3012483/ .
^ “Life without RNase P”. Nature 453 (7191): 120–3. (May 2008). doi :10.1038/nature06833 . PMID 18451863 . ^ “Structure and Function of Eukaryotic Ribonuclease P RNA” . Mol. Cell 24 (3): 445–56. (2006). doi :10.1016/j.molcel.2006.09.011 . PMC 1716732 . PMID 17081993 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1716732/ . ^ a b “Purification and characterization of the nuclear RNase P holoenzyme complex reveals extensive subunit overlap with RNase MRP” . Genes Dev. 12 (11): 1678–90. (1998). doi :10.1101/gad.12.11.1678 . PMC 316871 . PMID 9620854 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC316871/ .
^ “Characterization and purification of Saccharomyces cerevisiae RNase MRP reveals a new unique protein component”. J. Biol. Chem. 280 (12): 11352–60. (2005). doi :10.1074/jbc.M409568200 . PMID 15637077 . ^ “Differential association of protein subunits with the human RNase MRP and RNase P complexes” . RNA 12 (7): 1373–82. (2006). doi :10.1261/rna.2293906 . PMC 1484433 . PMID 16723659 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1484433/ . ^ Clayton DA (2001). “A big development for a small RNA”. Nature 410 (6824): 29–31. doi :10.1038/35065191 . PMID 11242026 . ^ “Eukaryotic RNase P RNA mediates cleavage in the absence of protein” . Proc. Natl. Acad. Sci. U.S.A. 104 (7): 2062–7. (2007). doi :10.1073/pnas.0607326104 . PMC 1892975 . PMID 17284611 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1892975/ . ^ “An important piece of the RNase P jigsaw solved”. Trends Biochem. Sci. 32 (6): 247–50. (2007). doi :10.1016/j.tibs.2007.04.005 . PMID 17485211 . ^ “RNase MRP Cleaves the CLB2 mRNA To Promote Cell Cycle Progression: Novel Method of mRNA Degradation” . Mol. Cell. Biol. 24 (3): 945–53. (2004). doi :10.1128/MCB.24.3.945-953.2004 . PMC 321458 . PMID 14729943 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC321458/ . ^ J. Holzmann; P. Frank; E. Löffler; K. Bennett; C. Gerner; W. Rossmanith (2008). “RNase P without RNA: Identification and functional reconstitution of the human mitochondrial tRNA processing enzyme”. Cell 135 (3): 462–474. doi :10.1016/j.cell.2008.09.013 . PMID 18984158 . ^ B. C. Thomas; X. Li; P. Gegenheimer (2000). “Chloroplast ribonuclease P does not utilize the ribozyme-type pre-tRNA cleavage mechanism” . RNA 6 (4): 545–553. doi :10.1017/S1355838200991465 . PMC 1369935 . PMID 10786845 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1369935/ . ^ a b c Trang, P; Kim, K; Liu, F (June 6, 2004). “Developing RNase P ribozymes for gene-targeting and antiviral therapy”. Cell Microbiology 6 (6): 499–508. doi :10.1111/j.1462-5822.2004.00398.x . PMID 15104592 .
^ Trang, P; Kilani, A; Lee, J; Hsu, A; Liou, K; Kim, J; Nassi, A; Kim, K et al. (August 25, 2002). “RNase P ribozymes for the studies and treatment of human cytomegalovirus infections”. J Clin Virol S2 : S63–74. doi :10.1016/s1386-6532(02)00097-5 . PMID 12361758 . ^ a b Dreyfus, David H.; Tompkins, S. Mark; Fuleihan, Ramsay; Ghoda, Lucy Y (2007). “Gene silencing in the therapy of influenza and other respiratory diseases: Targeting to RNase P by use of External Guide Sequences (EGS)” . Biologics: Targets and Therapy 1 (4): 425–32. PMC 2721295 . PMID 19707312 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2721295/ .
^ Zeng, WB; Chen, YC; Bai, Y; Trang, P; Vu, GP; Lu, SW; Wu, JG; Liu, FY (December 26, 2012). “Effective inhibition of Human Immunodeficiency Virus 1 replication by engineer RNase P ribozyme” . PLOS ONE 7 (12): e51855. doi :10.1371/journal.pone.0051855 . PMC 3530568 . PMID 23300569 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3530568/ . ^ Cobaleda, C; Sanchez-Garcia, I (2000). “In vivo inhibition by a site-specific catalytic RNA subunit of RNase P designed against the BCR-ABL oncogenic products: a novel approach for cancer treatment”. Blood 95 . ^ Sawyer, AJ; Wesolowski, D; Gandotra, N; Stojadinovic, A; Izadjoo, M; Altman, S; Kyriakides, TR (2013). “A peptide-morpholino oligomer conjugate targeting Staphylococcus aureus gyrA mRNA improves healing in an infected mouse cutaneous wound model” . Int. J. Pharm. 453 (2): 651–655. doi :10.1016/j.ijpharm.2013.05.041 . PMC 3756894 . PMID 23727592 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3756894/ .