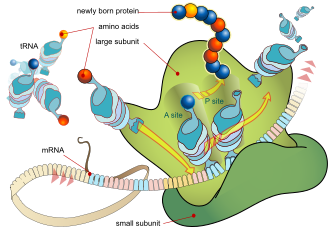
RNA Duta dengan nukleosida yang termodifikasi
|
Read other articles:

Jodi Widjanarko Wakil Komandan Pusat Kesenjataan InfanteriMasa jabatan27 April 2023 – 17 Juli 2023 PendahuluAsep Setia GunawanPenggantiToto NurwantoPa Sahli Tk. III Kasad Bidang Intekmil dan SiberMasa jabatan16 Januari 2023 – 27 April 2023 PendahuluSapriadiPenggantiLegowo W.R. JatmikoKepala Staf Komando Daerah Militer III/SiliwangiMasa jabatan27 Juni 2022 – 16 Januari 2023 PendahuluAsep SyaripudinPenggantiAgus SaepulKomandan Komando Resor Militer 084/Bhaskara ...

سفارة البحرين لدى المملكة المتحدة البحرين المملكة المتحدة الإحداثيات 51°29′54″N 0°09′09″W / 51.4984°N 0.1525°W / 51.4984; -0.1525 البلد المملكة المتحدة المكان لندن العنوان 30 Belgrave Square السفير فواز بن محمد آل خليفة الاختصاص المملكة المتحدة، والسويد[1]، وجمهورية أ�...

العلاقات البحرينية البرازيلية البحرين البرازيل البحرين البرازيل تعديل مصدري - تعديل العلاقات البحرينية البرازيلية هي العلاقات الثنائية التي تجمع بين البحرين والبرازيل.[1][2][3][4][5] مقارنة بين البلدين هذه مقارنة عامة ومرجعية للدولتين: �...

Town in North Rhine-Westphalia, GermanyKalkar TownMarktplatz in Kalkar Coat of armsLocation of Kalkar within Kleve district Kalkar Show map of GermanyKalkar Show map of North Rhine-WestphaliaCoordinates: 51°44′20″N 6°17′33″E / 51.73889°N 6.29250°E / 51.73889; 6.29250CountryGermanyStateNorth Rhine-WestphaliaAdmin. regionDüsseldorf DistrictKleve Subdivisions13Government • Mayor (2020–25) Britta Schulz[1]Area • Total88.2&...

العلاقات الألمانية الكندية ألمانيا كندا ألمانيا كندا تعديل مصدري - تعديل العلاقات الألمانية الكندية هي العلاقات الثنائية التي تجمع بين ألمانيا وكندا.[1][2][3][4][5] مقارنة بين البلدين هذه مقارنة عامة ومرجعية للدولتين: وجه المقارنة ألماني�...

Baseball team This article is about the 19th century baseball team. For the current New York National League baseball team, see New York Mets. For the 1891-founded Manhattan-based private social club, see The Metropolitan Club. New York MetropolitansInformationLeagueAmerican AssociationLocationNew York CityBallparkSt. George Cricket Grounds(1886–1887)Founded1880 (1880)Nickname(s)The MetsFormer ballparksPolo Grounds (1885)Metropolitan Park (1884)Polo Grounds (1883)ColorsTeal, black, whi...
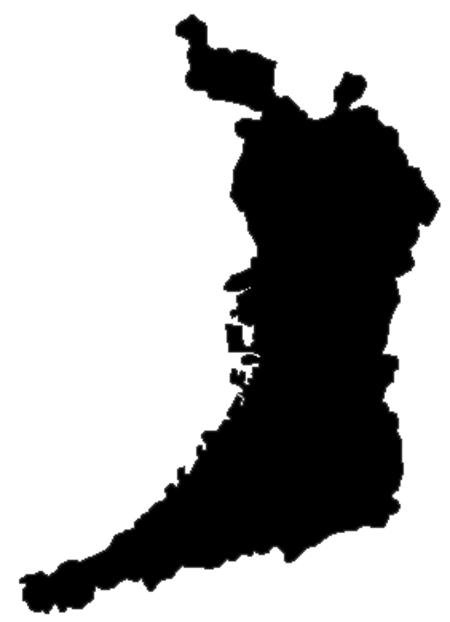
Map higashi-ku in the city Higashi-ku (東区) is a ward of the city of Sakai in Osaka Prefecture, Japan. The ward has an area of 10.48 km² and a population of 85,263. The population density is 8,136 per square kilometer.[1] The name means East Ward. The wards of Sakai were established when Sakai became a city designated by government ordinance on April 1, 2006. Transportation Rail Nankai Electric Railway Koya Line: Hatsushiba Station - Hagiharatenjin Station - Kitanoda Station ...

Davidson Wildcats 2024 Davidson Wildcats baseball teamFounded1902 (1902)UniversityDavidson CollegeHead coachRucker Taylor (6th season)ConferenceAtlantic 10LocationDavidson, North CarolinaHome stadiumT. Henry Wilson, Jr. Field (Capacity: 700)NicknameWildcatsColorsRed and black[1] NCAA regional champions2017NCAA Tournament appearances2017Conference tournament champions2017Regular season conference champions2022 For information on all Davidson College spor...

Sabeer Bhatia (Hindi: सबीर भाटिया, lahir 1968 di Chandigarh, India) ialah seorang pengusaha India-Amerika yang mendirikan Hotmail. Belajar di sekolah Yesuit di Bangalore, ia melanjutkan pendidikan di Birla Institute of Technology and Science di India lalu melanjutkannya ke Amerika Serikat untuk belajar di California Institute of Technology dan Stanford University dan setelah lulus bekerja di Apple Computer dan setelah menghemat waktu sejenak di sana ia bergabung dengan Fir...

Шалфей обыкновенный Научная классификация Домен:ЭукариотыЦарство:РастенияКлада:Цветковые растенияКлада:ЭвдикотыКлада:СуперастеридыКлада:АстеридыКлада:ЛамиидыПорядок:ЯсноткоцветныеСемейство:ЯснотковыеРод:ШалфейВид:Шалфей обыкновенный Международное научное наз...

Численность населения республики по данным Росстата составляет 4 003 016[1] чел. (2024). Татарстан занимает 8-е место по численности населения среди субъектов Российской Федерации[2]. Плотность населения — 59,00 чел./км² (2024). Городское население — 76,72[3] % (20...

San Anselmo Pueblo Ubicación en el condado de Marin y en el estado de California Ubicación de California en EE. UU.Coordenadas 37°58′48″N 122°34′05″O / 37.98, -122.568056Entidad Pueblo • País Estados Unidos • Estado California • Condado MarinAlcaldesa Barbara ThorntonFundación 9 de abril de 1908Superficie • Total 7.1 km² • Tierra 7.1 km² • Agua 0 km²Altitud • Media 14 m s. n. m.Població...

American baseball umpire (born 1979) Baseball player Vic CarapazzaBorn: (1979-07-06) July 6, 1979 (age 44)Port Jefferson, New York, U.S.MLB debutApril 9, 2010 Crew InformationUmpiring crew1Crew members#24 Jerry Layne (crew chief)#19 Vic Carapazza#78 Adam Hamari#32 Edwin Moscoso Career highlights and awardsSpecial Assignments All-Star Games (2014) Wild Card Games/Series (2020, 2022) Division Series (2014, 2015, 2016, 2017, 2021, 2023) League Championship Series (2018, 2022) World Series (...

1965 film by Virgil W. Vogel The Sword of Ali BabaTheatrical release posterDirected byVirgil W. VogelScreenplay byEdmund HartmannOscar BrodneyStory byEdmund HartmannProduced byHoward ChristieStarringPeter MannJocelyn LaneFrank McGrathPeter WhitneyCinematographyWilliam MarguliesEdited byGene PalmerMusic byFrank SkinnerProductioncompanyUniversal PicturesDistributed byUniversal PicturesRelease date April 1965 (1965-04) Running time81 minutesCountryUnited StatesLanguageEnglish The Sword...

2013 film directed by Jeffrey Friedman and Rob Epstein LovelaceTheatrical release posterDirected by Rob Epstein Jeffrey Friedman[1] Written byAndy Bellin[2]Produced by Laura Rister Jason Weinberg Jim Young Starring Amanda Seyfried Peter Sarsgaard Sharon Stone Adam Brody Juno Temple Eric Roberts James Franco Chris Noth Bobby Cannavale Hank Azaria Chloë Sevigny CinematographyEric Alan EdwardsEdited byRobert DalvaMusic byStephen TraskProductioncompanies Nu Image Millennium Films...

ReservationUte Mountain ReservationReservation FlagSealLocation of the Ute Mountain ReservationConstitution1940Seat of GovernmentTowaoc, ColoradoGovernment • BodyTribal Administration Department • Chairman of the Tribal Administration DepartmentHarold CuthairArea • Total2,238 km2 (864 sq mi)Population (2020) • Total1,656Time zoneMST/MDTWebsite[1] The Ute Mountain Ute Tribe /ˈjuːt/ (Ute dialect: Wʉgama Núuchi) is one of th...

American media and entertainment conglomerate Comcast NBCUniversal redirects here. For the parent company, see Comcast. NBCUniversal Media, LLCLogo used since Feb 2, 2011NBCUniversal's headquarters at the Comcast Building (30 Rockefeller Plaza) in New York CityTrade nameNBCUniversalFormerlyNBC Universal, Inc. (2004–2011)Company typeSubsidiaryIndustryMediaEntertainmentPredecessorsNBC line General Electric RCA Vivendi Seagram PolyGram MCA Inc. FoundedMay 11, 2004; 20 years ago (M...

American enterprise software companyThis article relies excessively on references to primary sources. Please improve this article by adding secondary or tertiary sources. Find sources: TIBCO Software – news · newspapers · books · scholar · JSTOR (January 2024) (Learn how and when to remove this message) TIBCO Software Incorporated.Company typeSubsidiaryIndustrySoftwareFounded1997; 27 years ago (1997)FoundersVivek RanadivéHeadquarters...

English actress (b. 1950) For the fictional character of the same name, see The 13th Man. DameJulie WaltersDBEWalters in 2014BornJulia Mary Walters (1950-02-22) 22 February 1950 (age 74)Edgbaston, Birmingham, EnglandAlma materManchester School of TheatreOccupationActressYears active1972–presentSpouse Grant Roffey (m. 1997)Children1 Dame Julia Mary Walters DBE (born 22 February 1950), known professionally as Julie Walters, is an English actress. ...

Premier of Alberta from 1943 to 1968 The HonourableErnest ManningPC CC AOEErnest Charles Manning, 19438th Premier of AlbertaIn officeMay 31, 1943 – December 12, 1968MonarchsGeorge VIElizabeth IILieutenant GovernorJohn C. BowenJohn J. BowlenJohn Percy PageGrant MacEwanPreceded byWilliam AberhartSucceeded byHarry E. StromSenator for Edmonton WestIn officeOctober 7, 1970 – September 20, 1983Appointed byPierre TrudeauMember of the Legislative Assembly of AlbertaI...