Kimia organotimah
|
Read other articles:

Artikel ini sebatang kara, artinya tidak ada artikel lain yang memiliki pranala balik ke halaman ini.Bantulah menambah pranala ke artikel ini dari artikel yang berhubungan atau coba peralatan pencari pranala.Tag ini diberikan pada Desember 2022. Asynapteron inca Klasifikasi ilmiah Kerajaan: Animalia Filum: Arthropoda Kelas: Insecta Ordo: Coleoptera Famili: Cerambycidae Genus: Asynapteron Spesies: Asynapteron inca Asynapteron inca adalah spesies kumbang tanduk panjang yang tergolong famili Cer...

Perang Inggris-Burma PertamaTanggal1823–1826LokasiBurma–IndiaHasil Kemenangan Inggris, Perjanjian YandabooPihak terlibat Inggris BurmaTokoh dan pemimpin Charles GrantSir Archibald Campbell Tharrawaddy MinMaha Bandula Perang Inggris-Burma Pertama berlangsung dari tahun 1823 hingga 1826. Di Inggris, perang ini disebut Perang Burma Pertama. Perang ini merupakan perang pertama dari tiga perang yang terjadi antara Burma dan Kekaisaran Inggris selama abad ke-19. Pranala luar Wikisource me...

Ulster HallLocationBedford StreetBelfastNorthern IrelandCoordinates54°35′40.780″N 5°55′49.732″W / 54.59466111°N 5.93048111°W / 54.59466111; -5.93048111OwnerBelfast City CouncilTypeConcert hallCapacity1,000 seated, or 1,850 standingConstructionBuilt1859Opened1862Renovated2009Websitewww.ulsterhall.co.uk The Ulster Hall is a concert hall and grade A listed building in Belfast, Northern Ireland. Situated on Bedford Street in Belfast city centre, the hall hosts...

Community/former town in Ontario, CanadaAncasterCommunity/former townThe historic 1834 Griffin HouseAncasterShow map of City of HamiltonAncasterShow map of Southern OntarioCoordinates: 43°13′32″N 79°58′36″W / 43.22556°N 79.97667°W / 43.22556; -79.97667CountryCanadaProvinceOntarioCityHamiltonAmalgamated2001 (with Hamilton)Government • MPFilomena Tassi • MPPSandy ShawArea • Total176.63 km2 (68.20 sq mi)Popul...

American political activist (born 1941) This article may be unbalanced towards certain viewpoints. Please improve the article by adding information on neglected viewpoints, or discuss the issue on the talk page. (February 2023)This biography of a living person relies too much on references to primary sources. Please help by adding secondary or tertiary sources. Contentious material about living persons that is unsourced or poorly sourced must be removed immediately, especially if potentially ...

Cet article est une ébauche concernant une localité de Californie. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants. Pour les articles homonymes, voir Cherry Valley. Cherry ValleyGéographiePays États-UnisÉtat CalifornieComté comté de RiversideSuperficie 20,94 km2 (2010)Surface en eau 0 %Altitude 860 mCoordonnées 33° 58′ 29″ N, 116° 58′ 13″ ODémographi...

1765–1791 period establishing the US This article is about political and social developments, and the origin and aftermath of the war. For military actions, see American Revolutionary War. For other uses, see American Revolution (disambiguation). American RevolutionPart of the Atlantic RevolutionsThe Continental Colors flag (1775–1777)The Committee of Five presenting its draft of the Declaration of Independence to the Second Continental Congress in Philadelphia on June 28, 1776, depicted ...

This article does not cite any sources. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Museo Municipal de Bellas Artes de Santa Cruz de Tenerife – news · newspapers · books · scholar · JSTOR (April 2016) (Learn how and when to remove this message) Art museum in Santa Cruz de Tenerife, SpainMuseo Municipal de Bellas Artes de Santa Cruz de TenerifeFacade of the muse...

This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Analysis of water chemistry – news · newspapers · books · scholar · JSTOR (September 2020) (Learn how and when to remove this message) Water chemistry analyses are carried out to identify and quantify the chemical components and properties of water samples. The...

Geodesy Fundamentals Geodesy Geodynamics Geomatics History Concepts Geographical distance Geoid Figure of the Earth (radius and circumference) Geodetic coordinates Geodetic datum Geodesic Horizontal position representation Latitude / Longitude Map projection Reference ellipsoid Satellite geodesy Spatial reference system Spatial relations Vertical positions Technologies Global Nav. Sat. Systems (GNSSs) Global Pos. System (GPS) GLONASS (Russia) BeiDou (BDS) (China) Galileo (Europe) NA...

location of Two Mile Square Reservation in Ohio The Two Mile Square Reservation or Two Mile Square Reserve was a tract of land in Ohio ceded by Native Americans to the United States of America in the Treaty of Greenville in 1795. It was subsequently surveyed in a manner different from surrounding land, and lots sold to settlers. History The Americans won the Battle of Fallen Timbers in 1794, ending the Northwest Indian War. As a result of the battle, the Treaty of Greenville was signed, which...

Disambiguazione – Se stai cercando altri significati, vedi Bisceglie (disambigua). Biscegliecomune Bisceglie – Veduta LocalizzazioneStato Italia Regione Puglia Provincia Barletta-Andria-Trani AmministrazioneSindacoAngelantonio Angarano (coalizione civica) dal 24-6-2018 (2º mandato dal 29-5-2023) TerritorioCoordinate41°14′27.36″N 16°30′07.42″E41°14′27.36″N, 16°30′07.42″E (Bisceglie) Altitudine16 m s.l.m. Superficie69,25 km...

Cemetery in Nunhead, London, England Nunhead CemeteryView up The Avenue from the North Gate towards the Anglican ChapelDetailsEstablished1840LocationLinden Grove, London, SE15 3LPCountryEnglandCoordinates51°27′51″N 0°03′11″W / 51.46423°N 0.05304°W / 51.46423; -0.05304TypePublicSize21 hectares (52 acres)WebsiteOfficial websiteFind a GraveNunhead Cemetery Grave of Vincent Figgins (d. 1844). Memorial designed by William Pettit Griffith. Nunhead Cemetery is one...

Suasana pitstop NASCAR di Richmond tahun 1985. Richmond International Raceway merupakan sebuah sirkuit balap di Amerika Serikat yang terletak di Richmond, Virginia. Sirkuit ini memiliki panjang 1,2 km dan memiliki kapasitas penonton sekitar 97.912 orang. Pertama kali dibuka pada tahun 1946 dan saat ini menjadi tempat penyelenggaraan balapan NASCAR bertajuk Crown Royal Presents The Your Name Here 400 dan Air Guard 400. Pembalap yang paling sering menang disini adalah Richard Petty dengan raiha...

American basketball player Kyle BaroneFree agentPositionCenterPersonal informationBorn (1989-09-12) September 12, 1989 (age 34)Orange County, California, U. S.Listed height6 ft 10 in (2.08 m)Listed weight250 lb (113 kg)Career informationHigh school Pacifica (Garden Grove, California) Summit Prep (Redwood City, California) CollegeIdaho (2009–2013)NBA draft2013: undraftedPlaying career2013–presentCareer history2013PGE Turów Zgorzelec2014Alba Fehérvár2014–2...

This article is about the British political party. For other uses, see Social Democratic Federation (United States) and Socialist Democratic Federation (Japan). Political party in the United Kingdom Social Democratic Federation LeaderHenry HyndmanFounded1881 (1881)Dissolved1911 (1911)Preceded byManhood Suffrage LeagueScottish Socialist FederationSucceeded byBritish Socialist PartySocialist Party of Great BritainHeadquartersLondonNewspaperJusticeIdeologySocialismPolitic...

Women's National Basketball Association Généralités Sport basket-ball Création 1996 Autre(s) nom(s) WNBA Organisateur(s) Women's National Basketball Association Éditions 27e Catégorie Nationale Périodicité Annuelle Lieu(x) États-Unis Participants 12 Directeur Cathy Engelbert[1]. Site web officiel wnba.com Palmarès Tenant du titre Aces de Las Vegas (2e titre) Plus titré(s) Comets de Houston, Lynx du Minnesota et Storm de Seattle (4) Pour la compétition en cours voir : Sa...

Qatari footballer Karim Boudiaf Boudiaf with Lekhwiya in 2011Personal informationFull name Karim Boudiaf[1]Date of birth (1990-09-16) 16 September 1990 (age 33)Place of birth Rueil-Malmaison, FranceHeight 1.90 m (6 ft 3 in)[2]Position(s) Defender / MidfielderTeam informationCurrent team Al-DuhailNumber 12Youth career2007–2008 Lorient2008–2010 NancySenior career*Years Team Apps (Gls)2010– Al-Duhail 243 (17)International career‡2013– Qatar 121 (6) M...

Ancient Egyptian temple complex This article is about the temple complex. For the commune, see Carnac. For other uses, see Karnak (disambiguation). KarnakPillars of the Great Hypostyle Hall from the Precinct of Amun-ReShown within EgyptLocationEl-Karnak, Luxor Governorate, EgyptRegionUpper EgyptCoordinates25°43′7″N 32°39′31″E / 25.71861°N 32.65861°E / 25.71861; 32.65861TypeSanctuaryPart ofThebesHistoryBuilderSenusret I–Nectanebo IMaterialStoneFounded...

لمعانٍ أخرى، طالع ألين (توضيح). ألين الإحداثيات 37°36′48″N 82°43′32″W / 37.61333°N 82.72556°W / 37.61333; -82.72556 [1] تاريخ التأسيس 1913 تقسيم إداري البلد الولايات المتحدة[2] التقسيم الأعلى مقاطعة فلويد خصائص جغرافية المساحة 600000 متر مربع0.497785 �...

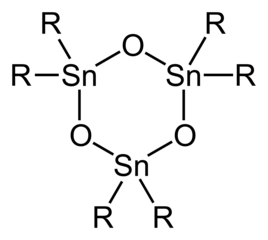


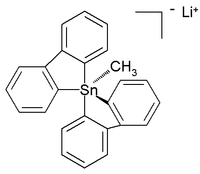



![Stille reaction scheme {\displaystyle {\ce {R-X+R'-SnR''_{3}->[{\ce {katalis\ Pd}}]R-R'+XSnR''_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0a379aef94a3faa5a650044dd11466554c89a8b3)







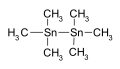
![Tetraetiltimah, titik didih 63–65° /12 mm adalah suatu katalis[20]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1e/Tetraethyltin.svg/120px-Tetraethyltin.svg.png)