Haluro de ácido
|
Read other articles:

العلاقات الأسترالية النيوزيلندية أستراليا نيوزيلندا أستراليا نيوزيلندا تعديل مصدري - تعديل العلاقات الأسترالية النيوزيلندية، والتي يشار إليها أيضًا بالعلاقات عبر تسمان (العلاقات عبر بحر تسمان)، هي علاقات وثيقة ومهمة للغاية. يشترك البلدان بالتراث الاست...
This article is about a 20th century voivodeship. For the 18th century one, see Chełm Voivodeship (1793). This article does not cite any sources. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Chełm Voivodeship – news · newspapers · books · scholar · JSTOR (December 2009) (Learn how and when to remove this template message) Chelm Voivodeship Chełm Voivodeship (...

Eurovision Song Contest 2007Country NetherlandsNational selectionSelection processInternal selectionSelection date(s)Artist: 16 December 2006Song: 11 February 2007Selected entrantEdsilia RombleySelected songOn Top of the WorldSelected songwriter(s)Tjeerd OosterhuisMartin GijzemijterMaarten ten HoveFinals performanceSemi-final resultFailed to qualify (21st)Netherlands in the Eurovision Song Contest ◄2006 • 2007 • 2008► The Netherlands participated in...

Military campaign during the American Civil War For the historic landmark, see Camden Expedition Sites National Historic Landmark. This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Camden Expedition – news · newspapers · books · scholar · JSTOR (January 2017) (Learn how and when to remove this template message...

Faculty of Medicine of the Chinese University of Hong Kong香港中文大學醫學院CUHK Medical Faculty EmblemMottoTransforming our passion into perfectionTypePublicEstablished1981; 43 years ago (1981)PresidentProfessor Rocky S. TuanDeanProfessor Philip Wai Yan ChiuLocationMa Liu Shui, Sha Tin, New Territories, Hong KongCampusSuburbAffiliationsPrince of Wales HospitalKowloon HospitalCUHK Medical CentreUnited Christian HospitalQueen Elizabeth HospitalWebsitewww.med.cuhk.ed...

Yunyan Pagoda The pagoda as viewed from the Tiger Hill Yunyan Pagoda in October 1921 The Tiger Hill Pagoda or Huqiu Pagoda (Chinese: 虎丘塔; pinyin: Hǔqiū tǎ; Suzhou Wu: Hou chieu thaeh, Wu Chinese pronunciation: [hou tɕʰʏ tʰɑʔ]), officially the Yunyan Pagoda[1] (Chinese: 云岩寺塔; pinyin: Yúnyán sì tǎ; Suzhou Wu: Yuin nge zy thaeh, Wu Chinese pronunciation: [ɦʏn ŋe̞ zz̩ tʰɑʔ]), is a Chinese pagoda situated on Tiger Hill (Huq...

DreamWorks Animation film MadagascarDirected by Eric Darnell Tom McGrath Written by Mark Burton Billy Frolick Eric Darnell Tom McGrath Produced byMireille SoriaStarring Ben Stiller Chris Rock David Schwimmer Jada Pinkett Smith Sacha Baron Cohen Cedric the Entertainer Andy Richter Edited byH. Lee PetersonMusic byHans ZimmerProductioncompanies DreamWorks Animation SKG PDI/DreamWorks Distributed byDreamWorks PicturesRelease dates May 27, 2005 (2005-05-27) (United States) Febru...

Contea di TerrellconteaLocalizzazioneStato Stati Uniti Stato federato Texas AmministrazioneCapoluogoSanderson Data di istituzione1905 TerritorioCoordinatedel capoluogo30°13′48″N 102°04′12″W / 30.23°N 102.07°W30.23; -102.07 (Contea di Terrell)Coordinate: 30°13′48″N 102°04′12″W / 30.23°N 102.07°W30.23; -102.07 (Contea di Terrell) Superficie6 107 km² Abitanti984 (2010) Densità0,16 ab./km² Altre informazioniLinguei...

An-38 Antonov An-38-100 milik Vostok Aviation Company Jenis Pesawat penumpang regional Pembuat Novosibirsk Aircraft Production Association Perancang Antonov Penerbangan perdana 23 Juni 1994 Diperkenalkan 2000 Status Operasional Pengguna utama Hangard AviationAlrosa Mirny Air EnterpriseVostok Airlines Jumlah 11 (6 operasional) Dikembangkan dari Antonov An-28 Antonov An-38 adalah versi perpanjangan dan peningkatan dari buatan Antonov sebelumnya, An-28. Pesawat ini merupakan pesawat transp...

Mall of Asia ArenaMall of Asia Arena pada tahun 2014LokasiBay City, Pasay, Metro Manila, FilipinaPemilikSM Prime HoldingsKapasitasDuduk: 15,000[1]Penuh: 20,000[2]KonstruksiDidirikan2010[3]Dibuka16 Juni 2012[4]BiayaUSD 77 juta 3.6 miliar Peso[3] Mall of Asia Arena adalah arena indoor yang berada di dalam kompleks SM Mall of Asia, berlokasi di Pasay, Filipina. Gedung ini memiliki kapasitas duduk 15,000 untuk acara olahraga, dan kapasitas penuh 20,000.[...

NGC 2481 الكوكبة التوأمان[1] رمز الفهرس NGC 2481 (الفهرس العام الجديد)2MASX J07571372+2346036 (Two Micron All-Sky Survey, Extended source catalogue)KPG 148b (Catalogue of isolated pairs of galaxies in the northern hemisphere)MCG+04-19-010 (فهرس المجرات الموروفولوجي)PGC 22292 (فهرس المجرات الرئيسية)UGC 4118 (فهرس أوبسالا العام)SDSS J075713.75+234603.9 (مسح سلون الر...

This article's lead section may be too short to adequately summarize the key points. Please consider expanding the lead to provide an accessible overview of all important aspects of the article. (August 2022) City in Illinois, United StatesElgin, IllinoisCityAerial view of downtown Elgin FlagSealNickname: The City in the SuburbsMotto: The Jewel of the MidwestLocation of Elgin in Kane and Cook CountiesElginShow map of Chicago metropolitan areaElginShow map of IllinoisElginShow map of...

United States trial level federal district court based in St. Louis, Missouri United States District Court for the Eastern District of Missouri(E.D. Mo.)LocationThomas F. Eagleton U.S. Courthouse(St. Louis)More locationsCape GirardeauHannibalAppeals toEighth CircuitEstablishedMarch 3, 1857Judges9Chief JudgeStephen R. ClarkOfficers of the courtU.S. AttorneySayler A. Fleming (acting)U.S. MarshalJohn D. Jordanmoed.uscourts.gov The United States District Court for the Eastern ...

Species of carnivore Banded linsang Conservation status Least Concern (IUCN 3.1)[2] CITES Appendix II (CITES)[2] Scientific classification Domain: Eukaryota Kingdom: Animalia Phylum: Chordata Class: Mammalia Order: Carnivora Suborder: Feliformia Family: Prionodontidae Genus: Prionodon Species: P. linsang[1] Binomial name Prionodon linsang[1](Hardwicke, 1821) Banded linsang range The banded linsang (Prionodon linsang) is a linsang, a tree-dwellin...

裸殻翼足類 クリオネの1種ハダカカメガイ Clione limacina 分類 界 : 動物界 Animalia 門 : 軟体動物門 Mollusca 綱 : 腹足綱 Gastropoda 亜綱 : 直腹足亜綱 Orthogastropoda 下綱 : Apogastropoda 上目 : 異鰓上目 Heterobranchia 目 : 裸殻翼足目 Gymnosomata 学名 Gymnosomata Blainville, 1824 英名 Sea Angel 科 ハダカカメガイ科 Clionidae クリオプシス科 Cliopsidae マメツブハダカカメガイ科 Hydromylidae Notobranchaeidae �...

Assedio di Novaraparte della Discesa di Carlo VIII in ItaliaData11 giugno - 24 settembre 1495 LuogoNovara CausaRivendicazione di Luigi d'Orléans del possesso di Milano EsitoVittoria della Lega Modifiche territorialiRitorno allo status quo Schieramenti Regno di FranciaLega Santa: Ducato di Milano Repubblica di Venezia Marchesato di Mantova Comandanti Luigi d'Orléans Galeazzo Sanseverino, Ludovico Sforza e Beatrice d'Este Bernardo Contarini, Luca Pisani e Melchiorre Trevisan Francesco II Gonz...

Cet article est une ébauche concernant le basket-ball. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants. Rasheed Wallace (#36) envoie la balle à Ben Wallace pour un alley-oop lors d'un match contre les Spurs en 2005. Un alley-oop est, en basket-ball, une variante du slam dunk qui consiste à reprendre une passe en vol pour aller dunker, c'est-à-dire la mettre directement dans le panier. L'action est spectaculai...

This figure shows pathway of acetone–butanol–ethanol fermentation by clostridia. تخمر الأسيتون-البيوتانول-الإيثانول،إن عملية تخمر الأسيتون والبيوتانول والايثانول (ABE) هي عملية تستخدم التخمر البكتيري لإنتاج الأسيتون، البوتانول، والايثانول من الكربوهيدرات مثل النشا والجلوكوز. تم تطويره من قبل الكيميائي ح�...

Canadian architect (1929–2023) Raymond MoriyamaCC OOnt FRAICBorn(1929-10-11)October 11, 1929Vancouver, British Columbia, CanadaDiedSeptember 1, 2023(2023-09-01) (aged 93)Toronto, Ontario, CanadaAlma materUniversity of TorontoMcGill School of ArchitectureOccupationArchitectChildren5AwardsGovernor General's Award in Visual and Media ArtsRAIC Gold MedalQueen Elizabeth II Golden Jubilee MedalPracticeMoriyama & Teshima ArchitectsBuildingsCanadian War MuseumOttawa City Hall...

Pour les articles homonymes, voir Cesaro. Claudio CastagnoliClaudio en juin 2022 à AEW x NJPW: Forbidden DoorDonnées généralesNom de naissance Claudio CastagnoliNom de ring Claudio CastagnoliAntonio CesaroCesaroNationalité SuisseNaissance 27 décembre 1980 (43 ans)LucerneLieu de résidence OrlandoTaille 6′ 5″ (1,96 m)[1]Poids 232 lb (105 kg)[1]Catcheur en activitéFédération All Elite WrestlingCHIKARACombat Zone WrestlingPro Wrestling GuerillaRing of Honor...






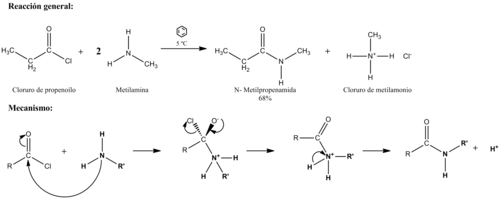



![{\displaystyle R-COCl+C_{6}H_{6}{\xrightarrow[{}]{AlCl_{3}}}C_{6}H_{5}-CO-R+HCl}](https://wikimedia.org/api/rest_v1/media/math/render/svg/585b37b066b3fdbe7d1b68bd7f42cd3a88621287)

![{\displaystyle R-COCl+[(CH_{3})_{3}-CO]_{3}AlLi-H\longrightarrow R-CHO}](https://wikimedia.org/api/rest_v1/media/math/render/svg/200790ce6cb62da855703d53bd39dff35c340112)
