Die Nitroxylole (auch Dimethylnitrobenzole oder Nitroxylene genannt) bilden eine Stoffgruppe, die sich sowohl vom Toluol bzw. den Xylolen als auch vom Nitrobenzol ableitet. Die Struktur besteht aus einem Benzolring mit zwei angefügten Methylgruppen (–CH3) und einer Nitrogruppe (–NO2) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich sechs Konstitutionsisomere mit der Summenformel C8H9NO2. Sie werden durch Nitrieren von Xylol gewonnen und wurden zuerst 1885 von Emilio Noelting systematisch studiert.[1] Je nach Grad der Nitrierung teilt man sie ein in:
Gewinnung und Eigenschaften
Die Nitroxylole werden durch Nitrieren (z. B. mit einem Salpetersäure-Schwefelsäure-Gemisch) von Xylol gewonnen; bei der Umsetzung von m-Xylol entsteht ein Isomerengemisch aus 75 % 2,4-Dimethylnitrobenzol (4-Nitro-m-xylol), 25 % 2,6-Dimethylnitrobenzol (2-Nitro-m-xylol), und wenig 3,5-Dimethylnitrobenzol (5-Nitro-m-xylol).[1] Sie fallen hier als gelbliche Flüssigkeiten an, die schlecht löslich sind in Wasser, dagegen löslich in organischen Lösungsmitteln. Die Dichte beträgt durchschnittlich 1,12 g/cm3; die Nitroxylole sind daher alle schwerer als Wasser.
Die Nitroxylole haben eine geringe akute orale Toxizität (LD50 um oder oberhalb 2000 mg/kg bei weiblichen Ratten), es gibt bei den meisten Isomeren Hinweise auf eine mutagene Wirkung.[2]
| Nitroxylole
|
| Name
|
2,3-Dimethyl-
nitrobenzol
|
2,4-Dimethyl-
nitrobenzol
|
2,5-Dimethyl-
nitrobenzol
|
2,6-Dimethyl-
nitrobenzol
|
3,4-Dimethyl-
nitrobenzol
|
3,5-Dimethyl-
nitrobenzol
|
| andere Namen
|
3-Nitro-o-xylol |
4-Nitro-m-xylol |
2-Nitro-p-xylol |
2-Nitro-m-xylol |
4-Nitro-o-xylol |
5-Nitro-m-xylol
|
| Strukturformel
|

|
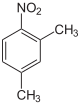
|
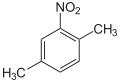
|

|

|

|
| CAS-Nummer
|
83-41-0 |
89-87-2 |
89-58-7 |
81-20-9 |
99-51-4 |
99-12-7
|
| 25168-04-1 (Isomerengemisch)
|
| PubChem
|
6739 |
6991 |
6974 |
6672 |
7440 |
7426
|
| Summenformel
|
C8H9NO2
|
| Molare Masse
|
151,16 g·mol−1
|
| Aggregatzustand
|
flüssig
|
fest
|
| Kurzbeschreibung
|
gelbliche Flüssigkeit
|
gelbe, kristalline Feststoffe
|
| Schmelzpunkt
|
15 °C[3]
|
2 °C[4]
|
2 °C[5]
|
14–16 °C[6]
|
30,5–32 °C[7]
|
72–74 °C[8]
|
| Siedepunkt
|
240–245 °C[3]
|
245 °C[4]
|
240 °C[5]
|
222–224 °C[6]
|
255–257 °C[7]
|
273 °C (985 hPa)[8]
|
| Löslichkeit
|
schlecht löslich in Wasser, löslich in Ethanol, Ether und Chloroform
|
GHS-
Kennzeichnung
|
Achtung[3]
|
Achtung[4]
|
[5]
|
Achtung[6]
|
[7]
|
Gefahr[8]
|
| H- und P-Sätze
|
411
|
302‐412
|
keine H-Sätze
|
302‐411
|
keine H-Sätze
|
301‐311‐331‐373
|
| keine EUH-Sätze
|
keine EUH-Sätze
|
keine EUH-Sätze
|
keine EUH-Sätze
|
keine EUH-Sätze
|
keine EUH-Sätze
|
| 273‐391‐501
|
264‐270‐273‐301+312‐330‐501
|
keine P-Sätze
|
264‐270‐273‐301+312‐391‐501
|
keine P-Sätze
|
280‐301+310+330‐302+352+312
304+340+311‐314
|
Verwendung
Nitroxylole werden als Zwischenprodukte bei der Herstellung von Farbstoffen (z. B. Xylidine), Insektiziden, Herbiziden und Arzneimittel verwendet.[9] Nitro-o-xylol wird zur Herstellung von 3,4-Xylidin verwendet, aus dem über mehrere Stufen Riboflavin (Vitamin B2) hergestellt wird.[10] Da Nitroxylole außerdem zur Herstellung von Sprengstoffen verwendet werden, sind sie wie die Nitrotoluole und 2,4-Dinitrotoluol als Rüstungsaltlast im Boden und Grundwasser nachzuweisen.
Weblinks
Einzelnachweise
- ↑ a b Produktion von Nitroxylolen (Memento vom 9. März 2012 im Internet Archive).
- ↑ @1@2Vorlage:Toter Link/explosionsschutzinfo.deVergleichende Betrachtung der toxikologischen Wirkung fünf verschiedener Nitroxylole (Seite dauerhaft nicht mehr abrufbar, festgestellt im Mai 2019. Suche in Webarchiven) (PDF; 58 kB), abgerufen am 22. August 2012.
- ↑ a b c Eintrag zu 3-Nitro-o-xylol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Januar 2024. (JavaScript erforderlich)
- ↑ a b c Eintrag zu 4-Nitro-m-xylol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Januar 2024. (JavaScript erforderlich)
- ↑ a b c Eintrag zu 2-Nitro-p-xylol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Januar 2024. (JavaScript erforderlich)
- ↑ a b c Eintrag zu 2-Nitro-m-xylol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Januar 2024. (JavaScript erforderlich)
- ↑ a b c Eintrag zu 4-Nitro-o-xylol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Januar 2024. (JavaScript erforderlich)
- ↑ a b c Eintrag zu 5-Nitro-m-xylol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Januar 2024. (JavaScript erforderlich)
- ↑ Toxikologische Bewertung von 4-Nitro-1,3-dimethylbenzol (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 22. August 2012.
- ↑ Toxikologische Bewertung von @1@2Vorlage:Toter Link/www.bgrci.de4-Nitro-1,2-dimethylbenzol (Seite dauerhaft nicht mehr abrufbar, festgestellt im Mai 2019. Suche in Webarchiven) (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 22. August 2012.