Relació fonamental de la termodinàmica
|
Read other articles:

Neopalpa donaldtrumpi Spesimen jantan dewasa Klasifikasi ilmiah Kerajaan: Animalia Filum: Arthropoda Kelas: Insecta Ordo: Lepidoptera Famili: Gelechiidae Genus: Neopalpa Spesies: N. donaldtrumpi Nama binomial Neopalpa donaldtrumpiNazari, 2017 Persebaran dari N. donaldtrumpi (segitiga kuning) Neopalpa donaldtrumpi adalah spesies ngengat dalam genus Neopalpa yang hidup di California Selatan dan Meksiko Utara. Ngengat itu dideskripsikan pada 2017 oleh ilmuwan Kanada Vazrick Nazari.[1&#...

Serpong EkspresKRL Serpong Ekspres dan Ekonomi di Stasiun SerpongIkhtisarJenisKereta komuterSistemCommuter LineStatusTidak BeroperasiLokasiDKI Jakarta (Jakarta Pusat dan Jakarta Selatan)Banten (Kabupaten Tangerang dan kota Tangerang Selatan)TerminusStasiun Tanah AbangStasiun SerpongStasiun8Layanan4OperasiDibuka1992Ditutup2011PemilikPT Perusahaan Umum Kereta Api (Persero)OperatorKAI CommuterDepoSerpongData teknisPanjang lintas24,6 km (15 mi 502 yd 2 ft 8 in)Lebar sepur...

Bangtelindo atau PT Pembangunan Telekomunikasi Indonesia adalah sebuah perusahaan di bidang jasa konsultasi, pemasangan, dan pemeliharaan sarana telekomunikasi dan merupakan anak perusahaan dari PT Telekomunikasi Indonesia (Telkom).[1] Perusahaan ini didirikan pada tahun 1993 dan beralamat di Jl.Mangga No 4, Bandung 40114 Indonesia.[2] Pemegang saham perusahaan ini terdiri dari Telkom (2.11%), Dana Pensiun Telkom (54.23%), PT Transdata Satkomindo (38.37%), Koperasi Telkom (2.6...

اختصاراتوب:أوبالأوتوويكي براوزر - v6.3.0.0 الصفحة الرئيسية معلومات عامة عن الأوتوويكي براوزر. طلب الموافقة الإذن باستخدام الأوتوويكي براوزر. الأسئلة المتكررة الأسئلة التي تتكرر دوما. مشاكل واستفسارات لأي أسئلة أو استفارات حول الأوتوويكي براوزر. طلب ميزة طلب ميزة جديدة في �...

Japanese camera brand This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Contax – news · newspapers · books · scholar · JSTOR (December 2019) (Learn how and when to remove this message) Contax II, 1936 Contax (stylised as CONTAX in the Kyocera era) began as a German camera model in the Zeiss Ikon line in 1932, ...

This is a list of cycle routes in London that have been waymarked with formal route signage include 'Cycleways' (including 'Cycle Superhighways' and 'Quietways) and the older London Cycle Network, all designated by the local government body Transport for London (TfL), National Cycle Network routes designated by the sustainable transport charity Sustrans, and miscellaneous 'Greenways' created by various bodies. Most recently, in May 2020 TfL announced its 'Streetspace for London' in response ...

Incidental music composed by Ludwig van Beethoven for Johann Wolfgang von Goethe's 1787 play Count of Egmont Overture from Egmont (9:01) Problems playing this file? See media help. Egmont, Op. 84 by Ludwig van Beethoven, is a set of incidental music pieces for the 1787 play of the same name by Johann Wolfgang von Goethe.[1] It consists of an overture followed by a sequence of nine pieces for soprano, male narrator, and full symphony orchestra. The male narrator is optional; he is not ...

Gengsi Gede-gedeanGenre Drama Roman Remaja Komedi PembuatMultivision PlusSutradaraAgus EliasPemeran Teuku Zacky Masayu Anastasia Zacky Zimah Marissa Christina Saipul Jamil Robby Tumewu Ferina Widodo Debby Sahertian Adi Firansyah Cut Memey Vienna Fridiana Ika Eviolina Dicky Suprapto Indra Widyawati Penggubah lagu temaIrman S. AzwarPenata musikUcok RadjagukgukNegara asalIndonesiaBahasa asliBahasa IndonesiaJmlh. episode(daftar episode)ProduksiProduser eksekutifGobind PunjabiProduserRaam P...

This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Aegean Maritime Museum – news · newspapers · books · scholar · JSTOR (June 2018) (Learn how and when to remove this message) Entrance The Aegean Maritime Museum is a maritime museum in Mykonos, Greece. The founder and chairman of the museum, George M. Drakopoul...

Artikel ini sebatang kara, artinya tidak ada artikel lain yang memiliki pranala balik ke halaman ini.Bantulah menambah pranala ke artikel ini dari artikel yang berhubungan atau coba peralatan pencari pranala.Tag ini diberikan pada Maret 2016. SMA Muhammadiyah 1 Unismuh MakassarInformasiDidirikan2006JenisSwastaKepala SekolahDr. Ir. Nasrullah MScJumlah kelas6 Kelas setiap tingkatJurusan atau peminatanIPA dan IPSRentang kelasX, XI IPA, XI IPS, XII IPA, XII IPSKurikulumKurikulum Tingkat...

Senior judge The Chief Justice of New South Wales is the senior judge of the Supreme Court of New South Wales and the highest-ranking judicial officer in the Australian state of New South Wales. The Chief Justice is both the judicial head of the Supreme Court as well as the administrative head, responsible for arranging the business of the court and establishing its rules and procedures. The current Chief Justice is Andrew Bell who was appointed by Governor Margaret Beazley. List of chief jus...

Basilika Bunda DukacitaBasilika Minor Bunda DukacitaPortugis: Basílica Menor de Nossa Senhora das DoresBasilika Bunda Dukacita30°01′57″S 51°14′08″W / 30.03250°S 51.23556°W / -30.03250; -51.23556Koordinat: 30°01′57″S 51°14′08″W / 30.03250°S 51.23556°W / -30.03250; -51.23556LokasiPorto AlegreNegaraBrasilDenominasiGereja Katolik RomaArsitekturStatusBasilika minorStatus fungsionalAktifAdministrasiKeuskupan AgungKeuskupan...

العلاقات النيوزيلندية الهندوراسية نيوزيلندا هندوراس نيوزيلندا هندوراس تعديل مصدري - تعديل العلاقات النيوزيلندية الهندوراسية هي العلاقات الثنائية التي تجمع بين نيوزيلندا وهندوراس.[1][2][3][4][5] مقارنة بين البلدين هذه مقارنة عامة ومرجعي...

For other uses, see Manfredonia (disambiguation). Comune in Apulia, ItalyManfredoniaComuneComune di ManfredoniaBasilica of SipontoManfredonia within the Province of FoggiaLocation of Manfredonia ManfredoniaLocation of Manfredonia in ItalyShow map of ItalyManfredoniaManfredonia (Apulia)Show map of ApuliaCoordinates: 41°38′N 15°55′E / 41.633°N 15.917°E / 41.633; 15.917CountryItalyRegionApuliaProvinceFoggia (FG)FrazioniBorgo Mezzanone, Riviera Sud (Sciali and Ippo...

Questa voce o sezione sugli argomenti allenatori di calcio italiani e calciatori italiani non cita le fonti necessarie o quelle presenti sono insufficienti. Puoi migliorare questa voce aggiungendo citazioni da fonti attendibili secondo le linee guida sull'uso delle fonti. Segui i suggerimenti dei progetti di riferimento 1, 2. Questa voce sugli argomenti allenatori di calcio italiani e calciatori italiani è solo un abbozzo. Contribuisci a migliorarla secondo le convenzioni di Wikip...

German churchman and chronicler (c. 1114–1158) For the later bishop of the same name, see Otto II (bishop of Freising). Otto of Freising, as depicted on a 13th-century stained glass window in the Cistercian Abbey of Heiligenkreuz, Austria Otto of Freising (Latin: Otto Frisingensis; c. 1114 – 22 September 1158) was a German churchman of the Cistercian order and chronicled at least two texts which carries valuable information on the political history of his own time. He was the bishop of Fr...
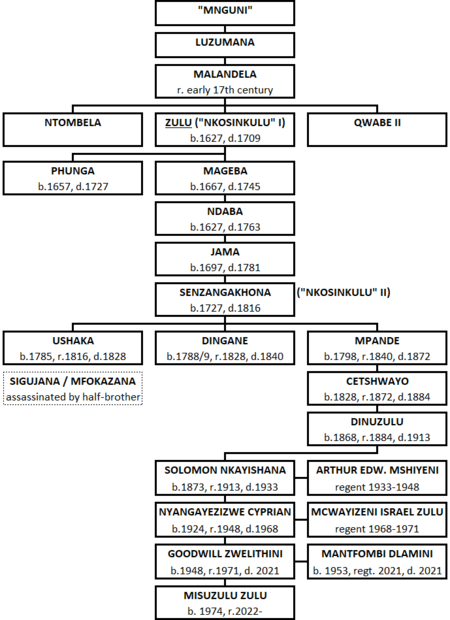
South African aristocracy Zulu royal familyCountryKwaZulu-Natal, South AfricaCurrent headMisuzulu Zulu Ka ZwelithiniTitlesKing, natively: Ingonyama yamaZulu The Zulu royal family, also known as the House of Zulu (Zulu: abakwaZulu, lit. 'people of the place of Zulu')[1] consists of the king of the Zulus, his consorts, and all of his legitimate descendants. The legitimate descendants of all previous kings are also sometimes considered to be members. History King Misuzulu k...

Spanish priest and prelate of Opus Dei In this Spanish name, the first or paternal surname is Ocáriz and the second or maternal family name is Braña. This biography of a living person needs additional citations for verification. Please help by adding reliable sources. Contentious material about living persons that is unsourced or poorly sourced must be removed immediately from the article and its talk page, especially if potentially libelous.Find sources: Fernando Ocáriz Brañ...
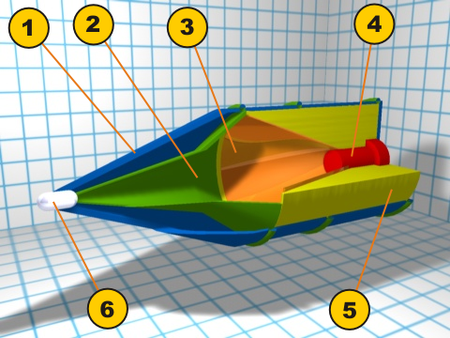
Explosive with focused effect 1: Ballistic cap; 2: Air-filled cavity; 3: Conical liner; 4: Detonator; 5: Explosive; 6: Piezo-electric trigger A shaped charge is an explosive charge shaped to focus the effect of the explosive's energy. Different types of shaped charges are used for various purposes such as cutting and forming metal, initiating nuclear weapons, penetrating armor, or perforating wells in the oil and gas industry. A typical modern shaped charge, with a metal liner on the charge c...

American industrialist (1855–1911) John W. Gates redirects here. For The New York politician, see John W. Gates (New York politician). John Warne GatesGates circa 1900Born(1855-05-18)May 18, 1855West Chicago, IllinoisDiedAugust 9, 1911(1911-08-09) (aged 56)Paris, French Third RepublicResting placeWoodlawn Cemetery, New York CityOther namesBet-a-MillionEducationNorth Central College, Wheaton CollegeOccupationIndustrialistKnown forSelling of barbed wire, gamblingSpouseDellora B...


















