 –ö–≤–į—Ä—Ü
–ö–≤–į—Ä—Ü
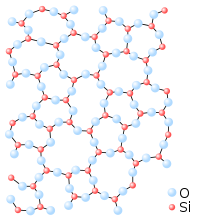 –ö–≤–į—Ä—Ü–ĺ–≤–ĺ —Ā—ā—ä–ļ–Ľ–ĺ
–ö–≤–į—Ä—Ü–ĺ–≤–ĺ —Ā—ā—ä–ļ–Ľ–ĺ
–°–ł–Ľ–ł—Ü–ł–Ķ–≤ –ī–ł–ĺ–ļ—Ā–ł–ī (–ĺ–ļ—Ā–ł–ī –Ĺ–į —Ā–ł–Ľ–ł—Ü–ł–Ļ (IV), SiO2) –Ķ —Ö–ł–ľ–ł—á–Ĺ–ĺ —Ā—ä–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł–Ķ –Ĺ–į —Ā–ł–Ľ–ł—Ü–ł—Ź ‚Äď –Ī–Ķ–∑—Ü–≤–Ķ—ā–Ĺ–ł –ļ—Ä–ł—Ā—ā–į–Ľ–ł, —Ā —ā–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–į –Ĺ–į —ā–ĺ–Ņ–Ķ–Ĺ–Ķ t—ā–ĺ–Ņ 1713 ‚Äď 1728 ¬įC, —Ā –≤–ł—Ā–ĺ–ļ–į —ā–≤—ä—Ä–ī–ĺ—Ā—ā –ł —Ź–ļ–ĺ—Ā—ā.
–°–≤–ĺ–Ļ—Ā—ā–≤–į
–ü–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑—ä–ľ
–°–ł–Ľ–ł—Ü–ł–Ķ–≤–ł—Ź—ā –ī–ł–ĺ–ļ—Ā–ł–ī –ł–ľ–į –Ĺ—Ź–ļ–ĺ–Ľ–ļ–ĺ –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–Ĺ–ł –ľ–ĺ–ī–ł—Ą–ł–ļ–į—Ü–ł–ł.
–Ě–į–Ļ-—Ä–į–∑–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–į—ā–į –ĺ—ā —ā—Ź—Ö –Ĺ–į –Ņ–ĺ–≤—ä—Ä—Ö–Ĺ–ĺ—Ā—ā—ā–į –Ĺ–į –∑–Ķ–ľ—Ź—ā–į –Ķ őĪ-–ļ–≤–į—Ä—Ü, –ļ–ĺ–Ļ—ā–ĺ –ļ—Ä–ł—Ā—ā–į–Ľ–ł–∑–ł—Ä–į –≤ —ā—Ä–ł–≥–ĺ–Ĺ–į–Ľ–Ĺ–į—ā–į —Ā–ł–Ĺ–≥–ĺ–Ĺ–ł—Ź.
–ü—Ä–ł –Ĺ–ĺ—Ä–ľ–į–Ľ–Ĺ–ł —É—Ā–Ľ–ĺ–≤–ł—Ź —Ā–ł–Ľ–ł—Ü–ł–Ķ–≤–ł—Ź—ā –ī–ł–ĺ–ļ—Ā–ł–ī —Ā–Ķ —Ā—Ä–Ķ—Č–į –Ĺ–į–Ļ-—á–Ķ—Ā—ā–ĺ –≤ –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–Ĺ–į—ā–į —Ā–ł –ľ–ĺ–ī–ł—Ą–ł–ļ–į—Ü–ł—Ź őĪ-–ļ–≤–į—Ä—Ü, –ļ–ĺ—Ź—ā–ĺ –Ņ—Ä–Ķ–ľ–ł–Ĺ–į–≤–į –ĺ–Ī—Ä–į—ā–ł–ľ–ĺ –≤ ő≤-–ļ–≤–į—Ä—Ü –Ņ—Ä–ł —ā–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–į –Ĺ–į–ī 573 ¬įC. –ü—Ä–ł –Ņ–ĺ-–Ĺ–į—ā–į—ā—ä—ą–Ĺ–ĺ —É–≤–Ķ–Ľ–ł—á–į–≤–į–Ĺ–Ķ –Ĺ–į —ā–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–į—ā–į –ļ–≤–į—Ä—Ü—ä—ā –Ņ—Ä–Ķ–ľ–ł–Ĺ–į–≤–į –≤ —ā—Ä–ł–ī–ł–ľ–ł—ā –ł –ļ—Ä–ł—Ā—ā–ĺ–Ī–į–Ľ–ł—ā. –Ę–Ķ–∑–ł –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–Ĺ–ł –ľ–ĺ–ī–ł—Ą–ł–ļ–į—Ü–ł–ł —Ā–į —É—Ā—ā–ĺ–Ļ—á–ł–≤–ł –Ņ—Ä–ł –≤–ł—Ā–ĺ–ļ–ł —ā–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–ł –ł –Ĺ–ł—Ā–ļ–ł –Ĺ–į–Ľ—Ź–≥–į–Ĺ–ł—Ź. –ü—Ä–ł –≤–ł—Ā–ĺ–ļ–ł —ā–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–ł –ł –Ĺ–į–Ľ—Ź–≥–į–Ĺ–ł—Ź —Ā–ł–Ľ–ł—Ü–ł–Ķ–≤–ł—Ź—ā –ī–ł–ĺ–ļ—Ā–ł–ī —Ā–Ķ –Ņ—Ä–Ķ–≤—Ä—ä—Č–į –ĺ—ā–Ĺ–į—á–į–Ľ–ĺ –≤ –ļ–ĺ–Ķ—Ā–ł—ā, –į —Ā–Ľ–Ķ–ī —ā–ĺ–≤–į –≤ —Ā—ā–ł—ą–ĺ–≤–ł—ā (–ļ–ĺ–Ļ—ā–ĺ –∑–į –Ņ—ä—Ä–≤–ł –Ņ—ä—ā –Ķ –Ĺ–į–ľ–Ķ—Ä–Ķ–Ĺ –≤ –Ķ–Ņ–ł—Ü–Ķ–Ĺ—ā—ä—Ä–į –Ĺ–į —Ź–ī—Ä–Ķ–Ĺ –≤–∑—Ä–ł–≤). –°–Ņ–ĺ—Ä–Ķ–ī –Ĺ—Ź–ļ–ĺ–ł –ł–∑—Ā–Ľ–Ķ–ī–≤–į–Ĺ–ł—Ź —Ā—ā–ł—ą–ĺ–≤–ł—ā—ä—ā —Ā—ä—Ā—ā–į–≤–Ľ—Ź–≤–į –∑–Ĺ–į—á–ł—ā–Ķ–Ľ–Ĺ–į —á–į—Ā—ā –ĺ—ā –∑–Ķ–ľ–Ĺ–į—ā–į –ľ–į–Ĺ—ā–ł—Ź, —ā–į–ļ–į —á–Ķ –≤—ä–Ņ—Ä–ĺ—Ā—ä—ā –∑–į —ā–ĺ–≤–į –ļ–ĺ—Ź —Ä–į–∑–Ĺ–ĺ–≤–ł–ī–Ĺ–ĺ—Ā—ā –Ĺ–į SiO2 –Ķ –Ĺ–į–Ļ-—Ä–į–∑–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–į –Ĺ–į –ó–Ķ–ľ—Ź—ā–į, –Ĺ—Ź–ľ–į –Ķ–ī–Ĺ–ĺ–∑–Ĺ–į—á–Ķ–Ĺ –ĺ—ā–≥–ĺ–≤–ĺ—Ä.
–°–ł–Ľ–ł—Ü–ł–Ķ–≤–ł—Ź—ā –ī–ł–ĺ–ļ—Ā–ł–ī –ł–ľ–į –ł –į–ľ–ĺ—Ä—Ą–Ĺ–į –ľ–ĺ–ī–ł—Ą–ł–ļ–į—Ü–ł—Ź ‚Äď –ļ–≤–į—Ä—Ü–ĺ–≤–ĺ —Ā—ā—ä–ļ–Ľ–ĺ.
–•–ł–ľ–ł—á–Ķ—Ā–ļ–ł —Ā–≤–ĺ–Ļ—Ā—ā–≤–į
–°–ł–Ľ–ł—Ü–ł–Ķ–≤–ł—Ź—ā –ī–ł–ĺ–ļ—Ā–ł–ī SiO2 –Ķ –ļ–ł—Ā–Ķ–Ľ–ł–Ĺ–Ķ–Ĺ –ĺ–ļ—Ā–ł–ī –ł –Ĺ–Ķ —Ä–Ķ–į–≥–ł—Ä–į —Ā –≤–ĺ–ī–į—ā–į.
–£—Ā—ā–ĺ–Ļ—á–ł–≤ –Ķ —Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ł –ļ—ä–ľ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ—ā–ĺ –Ĺ–į –ļ–ł—Ā–Ķ–Ľ–ł–Ĺ–ł, –Ĺ–ĺ —Ä–Ķ–į–≥–ł—Ä–į —Ā —Ą–Ľ—É–ĺ—Ä–ĺ–≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į –ļ–ł—Ā–Ķ–Ľ–ł–Ĺ–į:
SiO2 + 6HF ‚Üí H2[SiF6] + 2H2O,
–ł –≥–į–∑–ĺ–ĺ–Ī—Ä–į–∑–Ķ–Ĺ —Ą–Ľ—É–ĺ—Ä–ĺ–≤–ĺ–ī–ĺ—Ä–ĺ–ī HF:
SiO2 + 4HF ‚Üí SiF4‚ÜĎ + 2H2O.
–Ę–Ķ–∑–ł –ī–≤–Ķ —Ä–Ķ–į–ļ—Ü–ł–ł —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į—ā —ą–ł—Ä–ĺ–ļ–ĺ –∑–į —Ä–į–∑—Ź–∂–ī–į–Ĺ–Ķ (–Ķ—Ü–≤–į–Ĺ–Ķ) –Ĺ–į —Ā—ā—ä–ļ–Ľ–ĺ—ā–ĺ.
–ü—Ä–ł —Ā–Ņ–Ľ–į–≤—Ź–Ĺ–Ķ –Ĺ–į SiO2 —Ā –į–Ľ–ļ–į–Ľ–Ĺ–ł –ł –ĺ—Ā–Ĺ–ĺ–≤–Ĺ–ł –ĺ–ļ—Ā–ł–ī–ł, –į —Ā—ä—Č–ĺ —ā–į–ļ–į –ł —Ā –ļ–į—Ä–Ī–ĺ–Ĺ–į—ā–ł –Ĺ–į –į–ļ—ā–ł–≤–Ĺ–ł –ľ–Ķ—ā–į–Ľ–ł —Ā–Ķ –ĺ–Ī—Ä–į–∑—É–≤–į—ā —Ā–ł–Ľ–ł–ļ–į—ā–ł ‚Äď —Ā–ĺ–Ľ–ł –Ĺ–į —Ā–ł–Ľ–ł—Ü–ł–Ķ–≤–ł—ā–Ķ –ļ–ł—Ā–Ķ–Ľ–ł–Ĺ–ł, –ļ–ĺ–ł—ā–ĺ –Ĺ—Ź–ľ–į—ā –Ņ–ĺ—Ā—ā–ĺ—Ź–Ĺ–Ķ–Ĺ —Ā—ä—Ā—ā–į–≤.
–Ě–į–Ņ—Ä–ł–ľ–Ķ—Ä, –ľ–ĺ–∂–Ķ –ī–į —Ā–Ķ –Ņ–ĺ–Ľ—É—á–į—ā:
SiO2 + 4NaOH ‚Üí (2Na2O)¬∑SiO2 + 2H2O –ĺ—Ä—ā–ĺ—Ā–ł–Ľ–ł–ļ–į—ā –Ĺ–į –Ĺ–į—ā—Ä–ł—Ź,
SiO2 + –°–į–ě ‚Üí –°–į–ě¬∑SiO2 –ľ–Ķ—ā–į—Ā–ł–Ľ–ł–ļ–į—ā –Ĺ–į –ļ–į–Ľ—Ü–ł—Ź,
Na2CO3 + CaCO3 + 6SiO2 ‚Üí Na2O¬∑CaO¬∑6SiO2 + 2CO2‚ÜĎ –ł–Ľ–ł —Ā–ľ–Ķ—Ā–Ķ–Ĺ —Ā–ł–Ľ–ł–ļ–į—ā –Ĺ–į –ļ–į–Ľ—Ü–ł—Ź –ł –Ĺ–į—ā—Ä–ł—Ź.
–ě—ā –Ĺ–į—ā—Ä–ł–Ķ–≤ —Ā–ł–Ľ–ł–ļ–į—ā Na2O¬∑CaO¬∑6SiO2 —Ā–Ķ –Ņ—Ä–ĺ–ł–∑–≤–Ķ–∂–ī–į —Ā—ā—ä–ļ–Ľ–ĺ –∑–į –Ņ—Ä–ĺ–∑–ĺ—Ä—Ü–ł.
–Ę—Ä—Ź–Ī–≤–į –ī–į —Ā–Ķ –ĺ—ā–Ī–Ķ–Ľ–Ķ–∂–ł, —á–Ķ –Ņ–ĺ–≤–Ķ—á–Ķ—ā–ĺ —Ā–ł–Ľ–ł–ļ–į—ā–ł –Ĺ—Ź–ľ–į—ā –Ņ–ĺ—Ā—ā–ĺ—Ź–Ĺ–Ķ–Ĺ —Ā—ä—Ā—ā–į–≤. –ě—ā –≤—Ā–ł—á–ļ–ł —Ā–ł–Ľ–ł–ļ–į—ā–ł —Ā–į–ľ–ĺ –Ĺ–į—ā—Ä–ł–Ķ–≤–ł—ā–Ķ –ł –ļ–į–Ľ–ł–Ķ–≤–ł—ā–Ķ —Ā–ł–Ľ–ł–ļ–į—ā–ł —Ā–į —Ä–į–∑—ā–≤–ĺ—Ä–ł–ľ–ł –≤—ä–≤ –≤–ĺ–ī–į.
–ě—Ā–Ĺ–ĺ–≤–Ķ–Ĺ —Ā—ā—Ä—É–ļ—ā—É—Ä–Ķ–Ĺ –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā –ļ–į–ļ—ā–ĺ –Ĺ–į —ā–≤—ä—Ä–ī–ł—Ź —Ā–ł–Ľ–ł—Ü–ł–Ķ–≤ –ī–ł–ĺ–ļ—Ā–ł–ī, —ā–į–ļ–į –ł –Ĺ–į –≤—Ā–ł—á–ļ–ł —Ā–ł–Ľ–ł–ļ–į—ā–ł –Ķ –≥—Ä—É–Ņ–į—ā–į [SiO4/2], –≤ –ļ–ĺ—Ź—ā–ĺ –į—ā–ĺ–ľ—ä—ā –Ĺ–į —Ā–ł–Ľ–ł—Ü–ł—Ź Si –Ķ –ĺ–Ī–ļ—Ä—ä–∂–Ķ–Ĺ –ĺ—ā —ā–Ķ—ā—Ä–į–Ķ–ī—ä—Ä –ĺ—ā —á–Ķ—ā–ł—Ä–ł –į—ā–ĺ–ľ–į –ļ–ł—Ā–Ľ–ĺ—Ä–ĺ–ī –ě. –ü—Ä–ł —ā–ĺ–≤–į –≤—Ā–Ķ–ļ–ł –į—ā–ĺ–ľ –ļ–ł—Ā–Ľ–ĺ—Ä–ĺ–ī –Ķ —Ā–≤—ä—Ä–∑–į–Ĺ —Ā –ī–≤–į –į—ā–ĺ–ľ–į —Ā–ł–Ľ–ł—Ü–ł–Ļ. –§—Ä–į–≥–ľ–Ķ–Ĺ—ā–ł—ā–Ķ [SiO4/2] –ľ–ĺ–≥–į—ā –ī–į —Ā–Ķ —Ā–≤—ä—Ä–∑–≤–į—ā –Ķ–ī–ł–Ĺ —Ā –ī—Ä—É–≥ –Ņ–ĺ —Ä–į–∑–Ľ–ł—á–Ķ–Ĺ –Ĺ–į—á–ł–Ĺ. –°—Ä–Ķ–ī —Ā–ł–Ľ–ł–ļ–į—ā–ł—ā–Ķ —Ā–Ķ —Ä–į–∑–Ľ–ł—á–į–≤–į—ā –ĺ—Ā—ā—Ä–ĺ–≤–Ĺ–ł, –≤–Ķ—Ä–ł–∂–Ĺ–ł, –Ľ–Ķ–Ĺ—ā–ĺ–≤–ł, —Ā–Ľ–ĺ–Ķ—Ā—ā–ł, —á–Ķ—Ä—É–Ņ–ļ–ĺ–≤–ł –ł –ī—Ä—É–≥–ł —Ā–Ņ–ĺ—Ä–Ķ–ī —Ö–į—Ä–į–ļ—ā–Ķ—Ä–į –Ĺ–į –≤—Ä—ä–∑–ļ–į—ā–į –Ĺ–į —Ą—Ä–į–≥–ľ–Ķ–Ĺ—ā–ł—ā–Ķ [SiO4/2].
–ü–ĺ–Ľ—É—á–į–≤–į–Ĺ–Ķ
–°–ł–Ĺ—ā–Ķ—ā–ł—á–Ķ–Ĺ —Ā–ł–Ľ–ł—Ü–ł–Ķ–≤ –ī–ł–ĺ–ļ—Ā–ł–ī —Ā–Ķ –Ņ–ĺ–Ľ—É—á–į–≤–į —á—Ä–Ķ–∑ –Ĺ–į–≥—Ä—Ź–≤–į–Ĺ–Ķ –Ĺ–į —Ā–ł–Ľ–ł—Ü–ł–Ļ –ī–ĺ —ā–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–į 400 ‚Äď 500 ¬įC –≤ –ļ–ł—Ā–Ľ–ĺ—Ä–ĺ–ī–Ĺ–į –į—ā–ľ–ĺ—Ā—Ą–Ķ—Ä–į, –Ņ—Ä–ł –ļ–ĺ–Ķ—ā–ĺ —Ā–ł–Ľ–ł—Ü–ł—Ź—ā —Ā–Ķ –ĺ–ļ–ł—Ā–Ľ—Ź–≤–į –ī–ĺ –ī–ł–ĺ–ļ—Ā–ł–ī SiO2.
–í –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–Ĺ–ł —É—Ā–Ľ–ĺ–≤–ł—Ź —Ā–ł–Ĺ—ā–Ķ—ā–ł—á–Ķ–Ĺ —Ā–ł–Ľ–ł—Ü–ł–Ķ–≤ –ī–ł–ĺ–ļ—Ā–ł–ī –ľ–ĺ–∂–Ķ –ī–į –Ī—ä–ī–Ķ –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ —Ā —Ä–Ķ–į–ļ—Ü–ł—Ź –ľ–Ķ–∂–ī—É –ļ–ł—Ā–Ķ–Ľ–ł–Ĺ–ł –ł —Ā–ł–Ľ–ł–ļ–į—ā–Ĺ–ł —Ā–ĺ–Ľ–ł. –Ě–į–Ņ—Ä–ł–ľ–Ķ—Ä:
- Na2SiO3 + 2CH3COOH ‚Üí 2CH3COONa+H2SiO3,
—Ā–ł–Ľ–ł—Ü–ł–Ķ–≤–į—ā–į –ļ–ł—Ā–Ķ–Ľ–ł–Ĺ–į –≤–Ķ–ī–Ĺ–į–≥–į —Ā–Ķ —Ä–į–∑–Ľ–į–≥–į –Ĺ–į –≤–ĺ–ī–į –ł SiO2, –ļ–ĺ–Ļ—ā–ĺ —Ā–Ķ –ĺ—ā–Ľ–į–≥–į.
–Ę–į–ľ, –ļ—ä–ī–Ķ—ā–ĺ –Ĺ–Ķ –Ķ –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–į –≤–ł—Ā–ĺ–ļ–į —á–ł—Ā—ā–ĺ—ā–į –Ĺ–į –ľ–į—ā–Ķ—Ä–ł–į–Ľ–į, —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ —Ā–ł–Ľ–ł—Ü–ł–Ķ–≤ –ī–ł–ĺ–ļ—Ā–ł–ī –≤—ä–≤ –≤–ł–ī –Ĺ–į –Ņ—Ź—Ā—ä–ļ.
–ü—Ä–ł–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ
–°–ł–Ľ–ł—Ü–ł–Ķ–≤–ł—Ź—ā –ī–ł–ĺ–ļ—Ā–ł–ī —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į –≤ –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ—ā–ĺ –Ĺ–į —Ā—ā—ä–ļ–Ľ–ĺ, –ļ–Ķ—Ä–į–ľ–ł–ļ–į, –į–Ī—Ä–į–∑–ł–≤–ł, –Ī–Ķ—ā–ĺ–Ĺ, –∑–į –Ņ–ĺ–Ľ—É—á–į–≤–į–Ĺ–Ķ –Ĺ–į —Ā–ł–Ľ–ł—Ü–ł–Ļ, –ļ–į—ā–ĺ –Ņ—ä–Ľ–Ĺ–ł—ā–Ķ–Ľ –≤ –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ—ā–ĺ –Ĺ–į –≥—É–ľ–į, –Ņ—Ä–ł –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ—ā–ĺ –Ĺ–į –ĺ–≥–Ĺ–Ķ—É–Ņ–ĺ—Ä–Ĺ–ł –ľ–į—ā–Ķ—Ä–ł–į–Ľ–ł, –≤ —Ö—Ä–ĺ–ľ–į—ā–ĺ–≥—Ä–į—Ą–ł—Ź—ā–į –ł –ī—Ä.
–ö–≤–į—Ä—Ü–ĺ–≤–ł—ā–Ķ –ļ—Ä–ł—Ā—ā–į–Ľ–ł –Ņ—Ä–ł—ā–Ķ–∂–į–≤–į—ā –Ņ–ł–Ķ–∑–ĺ–Ķ–Ľ–Ķ–ļ—ā—Ä–ł—á–Ķ—Ā–ļ–ł —Ā–≤–ĺ–Ļ—Ā—ā–≤–į –ł —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į—ā –≤ —Ä–į–ī–ł–ĺ—ā–Ķ—Ö–Ĺ–ł–ļ–į—ā–į –ł —É–Ľ—ā—Ä–į–∑–≤—É–ļ–ĺ–≤–ł—ā–Ķ –į–Ņ–į—Ä–į—ā–ł.
–°–ł–Ľ–ł—Ü–ł–Ķ–≤–ł—Ź—ā –ī–ł–ĺ–ļ—Ā–ł–ī –Ķ –≥–Ľ–į–≤–Ķ–Ĺ –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā –Ĺ–į –Ņ–ĺ—á—ā–ł –≤—Ā–ł—á–ļ–ł —Ā–ļ–į–Ľ–ł –ł —Ā–Ķ —Ā—Ä–Ķ—Č–į –Ĺ–į–Ļ-—á–Ķ—Ā—ā–ĺ –ļ–į—ā–ĺ –Ņ—Ź—Ā—ä–ļ –ł –ļ—Ä–Ķ–ľ—ä–ļ.
–ė–∑–ļ—É—Ā—ā–≤–Ķ–Ĺ–ĺ –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–ł —ā—ä–Ĺ–ļ–ł —Ā–Ľ–ĺ–Ķ–≤–Ķ —Ā–ł–Ľ–ł—Ü–ł–Ķ–≤ –ī–ł–ĺ–ļ—Ā–ł–ī —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į—ā –ļ–į—ā–ĺ –ī–ł–Ķ–Ľ–Ķ–ļ—ā—Ä–ł–ļ –Ņ—Ä–ł –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ—ā–ĺ –Ĺ–į –ł–Ĺ—ā–Ķ–≥—Ä–į–Ľ–Ĺ–ł —Ā—Ö–Ķ–ľ–ł –ł –ī—Ä—É–≥–ł –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–Ĺ–ł –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā–ł.
–°–ł–Ľ–ł—Ü–ł–Ķ–≤–ł—Ź—ā –ī–ł–ĺ–ļ—Ā–ł–ī —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į –ł –∑–į –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ –Ĺ–į –ĺ–Ņ—ā–ł—á–Ĺ–ł –ļ–į–Ī–Ķ–Ľ–ł.