İyot heptaflorür
|
|
|
| Adlandırmalar
|
Diğer adlar İyot(VII) florür
Heptafloroiyot |
| Tanımlayıcılar
|
|
|
|
|
|
|
| ChemSpider
|
|
| ECHA InfoCard
|
100.037.241 
|
|
|
|
| UNII
|
|
|
|
|
InChI=1S/F7I/c1-8(2,3,4,5,6)7  Key: XRURPHMPXJDCOO-UHFFFAOYSA-N  InChI=1/F7I/c1-8(2,3,4,5,6)7 Key: XRURPHMPXJDCOO-UHFFFAOYAO
|
|
|
| Özellikler
|
| Molekül formülü
|
IF7
|
| Molekül kütlesi
|
259.90 g/mol
|
| Görünüm
|
renksiz gaz
|
| Yoğunluk
|
2.6 g/cm3 (6 °C)
2.7 g/cm3 (25 °C)
|
| Erime noktası
|
45 °C (113 °F; 318 K) (üçlü nokta)
|
| Kaynama noktası
|
48 °C (118 °F; 321 K)
|
| Çözünürlük (su içinde)
|
soluble [1]
|
| Benzeyen bileşikler
|
Benzeyen bileşikler
|
iyot pentaflorür
|
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
|
| Bilgi kutusu kaynakları
|
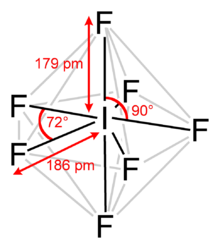
İyot heptaflorür, diğer adıyla iyot(VII) florür ya da iyot florür, IF7 kimyasal formülüne sahip interhalojen bileşiktir.[2][3] VSEPR teorisinde öngörüldüğü gibi alışılmadık bir beşgen bipiramidal yapıya sahiptir.[4] Molekül, Berry mekanizmasına benzeyen ancak heptakoordineli bir sistem için kullanılan sahte bir Bartell mekanizması isimli bir yeniden düzenlemeye tabi tutulabilir.[5] 4.5 °C'de eriyen renksiz kristallerden oluşur: sıvı aralığı son derece dardır, kaynama noktası 4.77 °C'dedir. Yoğun buhar, küflü ve buruk bir kokuya sahiptir. Molekül D5h simetriye sahiptir.
Hazırlanması
IF7 sıvı IF5'ten 90 °C'de F2 geçirilerek hazırlanır, sonra buhar 270 °C'ye ısıtılır. Alternatif olarak, bu bileşik, hidrolizden kaynaklanan bir safsızlık olan IOF5 oluşumunu en aza indirmek için flor ve kurutulmuş paladyum veya potasyum iyodürden hazırlanabilir.[6][7] İyot heptaflorür aynı zamanda, dioksijenil hekzafloroplatinat, iyot pentaflorür çözeltisi içinde potasyum florür kullanılarak potasyum heksafloroplatinat (V) gibi diğer platin(V) bileşiklerinin hazırlanması için kullanıldığında yan ürün olarak elde edilir.[8]
- 2 O2PtF6 + 2 KF + IF5 → 2 KPtF6 + 2 O2 + IF7
Güvenlik hususları
IF7 hem cildi, hem de mukoza zarını tahriş edicidir. Aynı zamanda güçlü bir oksitleyicidir ve organik malzeme ile temasında yangına neden olabilir.
Kaynakça
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, 0-07-049439-8
- ^ Macintyre, JE (Ed.). (1992). İnorganik Bileşikler Sözlüğü (Cilt 3). Londra: Chapman ve Salon.
- ^ O'Neil, Maryadele J. (Ed.). (2001). Merck İndeksi (13. basım). Whitehouse İstasyonu, NJ: Merck.
- ^
- ^ W. J. Adams; H. Bradford Thompson; L. S. Bartell (1970). "Structure, Pseudorotation, and Vibrational Mode Coupling in IF7: An Electron Diffraction Study". Journal of Chemical Physics. 53 (10): 4040–4046. doi:10.1063/1.1673876
- ^ Schumb, W. C.; Lynch, M. A. (1950). "Iodine Heptafluoride". Industrial & Engineering Chemistry. 42 (7): 1383–1386. doi:10.1021/ie50487a035
- ^ Ruff, O.; Keim, R. (1930). ""Das Jod-7-fluorid" (The iodine-7-fluoride)". Zeitschrift für Anorganische und Allgemeine Chemie (in German). 193 (1/2): 176–186. doi:10.1002/zaac.19301930117
- ^ Beveridge, A. D.; Clark, H. C. (1967). "Pentahalides of the Transition Metals". In Gutmann, Viktor. Halogen Chemistry 18 Şubat 2019 tarihinde Wayback Machine sitesinde arşivlendi.. 3. Academic Press. pp. 179–226. ISBN 9780323148474
Dış bağlantılar
|
|---|
| İyot(-I) | |
|---|
| İyot (I) | |
|---|
| İyot(III) | |
|---|
| İyot(V) | |
|---|
| İyot(VII) | |
|---|