Реакционный центр
| |||||||||||||||||||||||||||||
Read other articles:

Dinding penahan tanah pasangan batu berjenis dinding gravitasi Dinding penahan tanah atau dinding penahan adalah dinding yang relatif kaku dan digunakan untuk menyokong tanah secara lateral sehingga tanah dengan dua ketinggian berbeda di kedua sisi dinding dapat ditahan. Dinding penahan tanah merupakan struktur yang didesain untuk menahan tanah pada lereng yang secara alami tidak dapat bertahan (pada umumnya pada lereng curam, hampir vertikal, atau vertikal). Struktur ini digunakan untuk memb...

Diskografi T-araAlbum studio4Album kompilasi2Extended play8Singel36Album soundtrack14Promotional singles6Reissues6 Diskografi oleh penyanyi grup wanita dari Korea Selatan, T-ara terdiri dari beberapa Album studio, Album mini, Singel—termasuk dua sebagai artis fituring, soundtrack, album bungkus ulang studio, repackage album mini, dan singel promosi. Album Album studio Judul Rincian album Posisi teratas Penjualan Penghargaan KOR[1][a] JPN[3] Korea Absolute First Album...

River in Gorj County, RomaniaJaleșSohodolLocationCountryRomaniaCountiesGorj CountyVillagesRuncu, Răchiți, Stroiești, Stolojani, Tălpășești, CorneștiPhysical characteristicsMouthTismana • locationȘomănești • coordinates44°57′37″N 23°07′54″E / 44.9602°N 23.1318°E / 44.9602; 23.1318Length42 km (26 mi)Basin size242 km2 (93 sq mi)Basin featuresProgressionTismana→ Jiu→ Danube→ Bl...

لمعانٍ أخرى، طالع كينغستون (توضيح). كينغستون الإحداثيات 41°59′28″N 74°03′26″W / 41.9911°N 74.0572°W / 41.9911; -74.0572 [1] تقسيم إداري البلد الولايات المتحدة[2] التقسيم الأعلى مقاطعة أولستر خصائص جغرافية المساحة 7.75 ميل مربع ارتفاع 145 متر عدد...
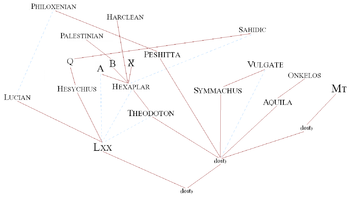
Bagian dari seriAlkitab Kanon Alkitabdan kitab-kitabnya Tanakh(Taurat · Nevi'im · Ketuvim)Kanon Alkitab Kristen · Alkitab IbraniPerjanjian Lama (PL) · Perjanjian Baru (PB) Deuterokanonika · Antilegomena Bab dan ayat dalam Alkitab Apokrifa:(Yahudi · PL · PB) Perkembangan dan Penulisan Penanggalan Kanon Yahudi Perjanjian Lama Kanon Perjanjian Baru Surat-surat Paulus Karya-karya Yohanes Surat-surat Petrus Terjemahandan N...

Island of Antarctica Sturge IslandSturge Island is the southernmost of the Balleny IslandsSturge IslandLocation in AntarcticaGeographyLocationAntarcticaCoordinates67°25′S 164°44′E / 67.417°S 164.733°E / -67.417; 164.733ArchipelagoBalleny IslandsArea437.2 km2 (168.8 sq mi)Length37 km (23 mi)Width12 km (7.5 mi)Highest elevation1,705 m (5594 ft)Highest pointBrown PeakAdministrationAdministered under the Antarc...

Artikel ini membutuhkan rujukan tambahan agar kualitasnya dapat dipastikan. Mohon bantu kami mengembangkan artikel ini dengan cara menambahkan rujukan ke sumber tepercaya. Pernyataan tak bersumber bisa saja dipertentangkan dan dihapus.Cari sumber: Franciscus Conradus Palaoensoeka – berita · surat kabar · buku · cendekiawan · JSTOR Franciscus Conradus Palaoensoeka Informasi pribadiLahirFranciscus Conradus Palaoensoeka(1923-05-19)19 Mei 1923Putussibau, K...

Perhitungan nilai π dengan menggunakan metode Monte Carlo. Metode Monte Carlo adalah algoritme komputasi untuk mensimulasikan berbagai perilaku sistem fisika dan matematika. Penggunaan klasik metode ini adalah untuk mengevaluasi integral definit, terutama integral multidimensi dengan syarat dan batasan yang rumit. Metode Monte Carlo sangat penting dalam fisika komputasi dan bidang terapan lainnya, dan memiliki aplikasi yang beragam mulai dari perhitungan kromodinamika kuantum esoterik hi...

Rosario CentralNama lengkapClub Atlético Rosario CentralJulukanCanalla La Academia RosarinaBerdiri24 Desember 1889; 134 tahun lalu (1889-12-24)StadionStadion Gigante de Arroyito,Rosario, Santa Fe,Argentina(Kapasitas: 48.900)PresidenRodolfo Di PollinaManajerMiguel Ángel RussoLigaDivisi Utama2017–2018ke-20Situs webSitus web resmi klub Kostum kandang Kostum tandang Musim ini Rosario Central adalah klub sepak bola Argentina yang berbasis di kota Rosario, Provinsi Santa Fe Argentina....

Questa voce o sezione deve essere rivista e aggiornata appena possibile. Sembra infatti che questa voce contenga informazioni superate e/o obsolete. Se puoi, contribuisci ad aggiornarla. Österreichischer SkiverbandLogo Discipline Sci alpino Sci nordico Fondazione4 novembre 1905 Nazione Austria ConfederazioneFederazione Internazionale Sci Unione Internazionale Biathlon Sede Innsbruck Presidente Roswitha Stadlober Sito ufficialewww.oesv.at/ Modifica dati su Wikidata · Manuale ...

Динамика численности населения Болгарии в 1961—2010-е годы Возрастно-половая пирамида населения Болгарии на 2020 год По состоянию на 31 декабря 2022 года численность населения Болгарии оценивается в 6 447 710 человек[1]. Согласно переписи населения по состоянию на 1 февраля 2011 г�...

A stretch of B C Road Ballygunge Circular Road which was renamed as Promotesh Barua Sarani (PIN Kolkata 700019), after the legendary actor and doyen of Bengali Cinema, is one of the most important roads which runs through the upscale part of Ballygunge in South Kolkata.[1] It starts near the Ballygunge Science College right off Gariahat Road, passing through landmarks like Tripura House, St Lawrence High School etc. before meeting Gurusaday Dutta Road about a mile up the road. It the...

Town in Jammu and Kashmir, IndiaThanamandiTownThanamandiLocation in Jammu and Kashmir, IndiaShow map of Jammu and KashmirThanamandiThanamandi (India)Show map of IndiaCoordinates: 33°33′N 74°23′E / 33.55°N 74.38°E / 33.55; 74.38Country IndiaUnion TerritoryJammu and KashmirDistrictRajouriElevation1,725 m (5,659 ft)Population (2011) • Total7,204Languages • OfficialDogri, Hindi, Urdu, Kashmiri, English[1][2&#...

Un'incisione del busto di Pierre-Charles Simart scolpito da Francisque Duret (1862) Pierre-Charles Simart (Troyes, 27 giugno 1806 – Parigi, 27 maggio 1857) è stato uno scultore francese. Indice 1 Biografia 2 Omaggi 3 Opere nelle collezioni pubbliche 4 Onorificenze 5 Note 6 Bibliografia 7 Altri progetti Biografia Figlio di Antoine Simart, un falegname di Troyes, e di Catherine Loiseau,[1] Pierre-Charles Simart manifestò molto precocemente delle doti per il disegno e la scultura. Do...

Former Irish broadcasting regulator Broadcasting Authority of IrelandÚdarás Craolacháin na hÉireannState Agency overviewFormed1 October 2009 (2009-10-01)Preceding agenciesBroadcasting Commission of IrelandBroadcasting Complaints CommissionDissolved15 March 2023 (2023-03-15)Superseding agencyCoimisiún na MeánJurisdictionIrelandHeadquarters2–5 Warrington Place, Dublin 2, D02 XP29State Agency executiveDr Pauric Travers, ChairmanKey documentBroadcasting Act 2...

Genus of true bugs native to North America Periodical cicada Specimen of Magicicada septendecim in the Bavarian State Collection of Zoology, Munich (2015) A Magicicada chorus with M. septendecim, M. cassini, and M. septendecula Scientific classification Domain: Eukaryota Kingdom: Animalia Phylum: Arthropoda Class: Insecta Order: Hemiptera Suborder: Auchenorrhyncha Family: Cicadidae Subfamily: Cicadettinae Tribe: Lamotialnini Genus: MagicicadaW. T. Davis, 1925 Type species Magicicada septendec...

British naval surgeon and explorer of Australia This article is about the explorer. For other uses, see George Bass (disambiguation). George BassEngraving of Bass from The Naval Pioneers of Australia by Louis Becke and Walter Jeffery, 1899Born(1771-01-30)30 January 1771Sleaford, Lincolnshire, EnglandDisappeared5 February 1803 (aged 32)Last seen before leaving Port Jackson, New South Wales, AustraliaNationalityBritishOccupation(s)Ship's surgeon and explorerSpouseElizabeth Waterhouse Georg...

Park in South London, England, UK This article is about Hampton Court Park or Home Park, London. For other uses, see Home Park (disambiguation). Home ParkSite of Special Scientific InterestLocationGreater LondonGrid referenceTQ167683InterestBiologicalArea88.9 hectaresNotification2014Location mapMagic Map Hampton Court, from the park Hampton Court Park, also known as Home Park, is a walled royal park managed by the Historic Royal Palaces.[1] The park lies between the gardens of Hampton...

Culinary traditions of Thailand Yam wun sen kung, a spicy Thai salad with glass noodles and prawns Part of a series on theCulture of Thailand Society People Thais History Languages Religion Education Folklore Holidays Women Cuisine Thai cuisine Curry Desserts Salads Street food Ingredients Dishes Art & Literature Architecture Thai art Costume Dance Music Painting Thai literature Poetry Comics Media Newspapers Radio Television Cinema Others Politics Sports Names Time Lunar Solar Symbols Sy...

Protein-coding gene in the species Homo sapiens ATF6IdentifiersAliasesATF6, ATF6A, ACHM7, activating transcription factor 6External IDsOMIM: 605537; MGI: 1926157; HomoloGene: 32015; GeneCards: ATF6; OMA:ATF6 - orthologsGene location (Human)Chr.Chromosome 1 (human)[1]Band1q23.3Start161,766,298 bp[1]End161,977,574 bp[1]Gene location (Mouse)Chr.Chromosome 1 (mouse)[2]Band1 H3|1 76.96 cMStart170,532,243 bp[2]End170,695,340 bp[2]RNA expression p...





