| –Ē–ł—Ö—Ä–ĺ–ľ–į—ā –Ĺ–į—ā—Ä–ł—Ź |
|---|
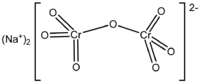 |
![]() |
| –Ę—Ä–į–ī–ł—Ü–ł–ĺ–Ĺ–Ĺ—č–Ķ –Ĺ–į–∑–≤–į–Ĺ–ł—Ź |
–ī–ł–Ĺ–į—ā—Ä–ł–Ķ–≤–į—Ź —Ā–ĺ–Ľ—Ć –ī–ł—Ö—Ä–ĺ–ľ–ĺ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č, –ī–ł–Ĺ–į—ā—Ä–ł–Ļ –ī–ł—Ö—Ä–ĺ–ľ–į—ā(VI) |
| –•–ł–ľ. —Ą–ĺ—Ä–ľ—É–Ľ–į |
Na2Cr2O7 |
| –°–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł–Ķ |
–ļ—Ä–į—Ā–Ĺ—č–Ķ –ī–ĺ –ĺ—Ä–į–Ĺ–∂–Ķ–≤—č—Ö –≥–ł–≥—Ä–ĺ—Ā–ļ–ĺ–Ņ–ł—á–Ĺ—č–Ķ –ļ—Ä–ł—Ā—ā–į–Ľ–Ľ—č |
| –ú–ĺ–Ľ—Ź—Ä–Ĺ–į—Ź –ľ–į—Ā—Ā–į |
|
| –ü–Ľ–ĺ—ā–Ĺ–ĺ—Ā—ā—Ć |
2,52 –≥/—Ā–ľ¬≥ |
|
–Ę–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–į |
| ‚ÄĘ –Ņ–Ľ–į–≤–Ľ–Ķ–Ĺ–ł—Ź |
(–į–Ĺ–≥–ł–ī—Ä–ł–ī) 356,7 ¬įC
(–ī–ł–≥–ł–ī—Ä–į—ā) –ĺ–ļ–ĺ–Ľ–ĺ 100 ¬įC |
| ‚ÄĘ —Ä–į–∑–Ľ–ĺ–∂–Ķ–Ĺ–ł—Ź |
400 ¬įC |
|
–≠–Ĺ—ā–į–Ľ—Ć–Ņ–ł—Ź |
| ‚ÄĘ –ĺ–Ī—Ä–į–∑–ĺ–≤–į–Ĺ–ł—Ź |
‚ąí1962 –ļ–Ē–∂/–ľ–ĺ–Ľ—Ć |
|
–†–į—Ā—ā–≤–ĺ—Ä–ł–ľ–ĺ—Ā—ā—Ć |
| ‚ÄĘ –≤ –≤–ĺ–ī–Ķ |
(–Ņ—Ä–ł 20 ¬įC) 236 –≥/100 –ľ–Ľ |
| ‚ÄĘ –≤ –ĺ—Ā—ā–į–Ľ—Ć–Ĺ—č—Ö –≤–Ķ—Č–Ķ—Ā—ā–≤–į—Ö |
—Ä–į—Ā—ā–≤–ĺ—Ä–ł–ľ –≤ —Ā–Ņ–ł—Ä—ā–Ķ |
| –†–Ķ–≥. –Ĺ–ĺ–ľ–Ķ—Ä CAS |
10588-01-9
(–ī–ł–≥–ł–ī—Ä–į—ā) 7789-12-0 |
| PubChem |
25408 –ł 129628287 |
| –†–Ķ–≥. –Ĺ–ĺ–ľ–Ķ—Ä EINECS |
234-190-3 |
| SMILES |
|
| InChI |
|
| RTECS |
HX7750000 (–į–Ĺ–≥–ł–ī—Ä–ł–ī, –ī–ł–≥–ł–ī—Ä–į—ā) |
| ChEBI |
39483 |
| –Ě–ĺ–ľ–Ķ—Ä –ě–ě–Ě |
3288 |
| ChemSpider |
23723 |
| –ü—Ä–Ķ–ī–Ķ–Ľ—Ć–Ĺ–į—Ź –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł—Ź |
0,01 –ľ–≥/–ľ¬≥ |
| –õ–Ē50 |
50 –ľ–≥/–ļ–≥ (–ļ—Ä—č—Ā—č, –ĺ—Ä–į–Ľ—Ć–Ĺ–ĺ) |
| –Ę–ĺ–ļ—Ā–ł—á–Ĺ–ĺ—Ā—ā—Ć |
–≤—č—Ā–ĺ–ļ–ĺ—ā–ĺ–ļ—Ā–ł—á–Ķ–Ĺ, –ļ–į–Ĺ—Ü–Ķ—Ä–ĺ–≥–Ķ–Ĺ, –ľ—É—ā–į–≥–Ķ–Ĺ, –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ, —Ā–ł–Ľ—Ć–Ĺ—č–Ļ –ĺ–ļ–ł—Ā–Ľ–ł—ā–Ķ–Ľ—Ć |
| –ü–ł–ļ—ā–ĺ–≥—Ä–į–ľ–ľ—č ECB |
     |
| NFPA 704 |
|
| –ü—Ä–ł–≤–Ķ–ī–Ķ–Ĺ—č –ī–į–Ĺ–Ĺ—č–Ķ –ī–Ľ—Ź —Ā—ā–į–Ĺ–ī–į—Ä—ā–Ĺ—č—Ö —É—Ā–Ľ–ĺ–≤–ł–Ļ (25 ¬įC, 100 –ļ–ü–į), –Ķ—Ā–Ľ–ł –Ĺ–Ķ —É–ļ–į–∑–į–Ĺ–ĺ –ł–Ĺ–ĺ–Ķ. |
 –ú–Ķ–ī–ł–į—Ą–į–Ļ–Ľ—č –Ĺ–į –í–ł–ļ–ł—Ā–ļ–Ľ–į–ī–Ķ –ú–Ķ–ī–ł–į—Ą–į–Ļ–Ľ—č –Ĺ–į –í–ł–ļ–ł—Ā–ļ–Ľ–į–ī–Ķ |
–Ē–ł—Ö—Ä–ĺ–ľ–įŐĀ—ā –Ĺ–įŐĀ—ā—Ä–ł—Ź (–Ī–ł—Ö—Ä–ĺ–ľ–į—ā –Ĺ–į—ā—Ä–ł—Ź, –Ĺ–į—ā—Ä–ł–Ķ–≤—č–Ļ —Ö—Ä–ĺ–ľ–Ņ–ł–ļ) ‚ÄĒ –Ĺ–Ķ–ĺ—Ä–≥–į–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ —Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ĺ–Ķ —Ā–ĺ–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł–Ķ, –Ĺ–į—ā—Ä–ł–Ķ–≤–į—Ź —Ā–ĺ–Ľ—Ć –ī–ł—Ö—Ä–ĺ–ľ–ĺ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č. –°—É—Č–Ķ—Ā—ā–≤—É–Ķ—ā –ī–ł–≥–ł–ī—Ä–į—ā –ī–ł—Ö—Ä–ĺ–ľ–į—ā–į –Ĺ–į—ā—Ä–ł—Ź (Na2Cr2O7¬∑2H2O) –ł –Ī–Ķ–∑–≤–ĺ–ī–Ĺ–į—Ź —Ā–ĺ–Ľ—Ć.
–ü–ĺ–Ľ—É–Ņ—Ä–ĺ–ī—É–ļ—ā –≤ –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–Ķ —Ö—Ä–ĺ–ľ–į, –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł –≤—Ā—Ź —Ö—Ä–ĺ–ľ–ĺ–≤–į—Ź —Ä—É–ī–į –Ņ–Ķ—Ä–Ķ—Ä–į–Ī–į—ā—č–≤–į–Ķ—ā—Ā—Ź –≤ –ī–ł—Ö—Ä–ĺ–ľ–į—ā –Ĺ–į—ā—Ä–ł—Ź.
–°–Ľ–Ķ–ī—É–Ķ—ā —É—á–ł—ā—č–≤–į—ā—Ć, —á—ā–ĺ –ī–ł—Ö—Ä–ĺ–ľ–į—ā –Ĺ–į—ā—Ä–ł—Ź –ĺ—á–Ķ–Ĺ—Ć —ā–ĺ–ļ—Ā–ł—á–Ķ–Ĺ.
–•–ł–ľ–ł—á–Ķ—Ā–ļ–ł–Ķ —Ā–≤–ĺ–Ļ—Ā—ā–≤–į
–° —ā–ĺ—á–ļ–ł –∑—Ä–Ķ–Ĺ–ł—Ź —Ä–Ķ–į–ļ—Ü–ł–ĺ–Ĺ–Ĺ–ĺ–Ļ —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā–ł –ł –≤–Ĺ–Ķ—ą–Ĺ–Ķ–≥–ĺ –≤–ł–ī–į –ī–ł—Ö—Ä–ĺ–ľ–į—ā –Ĺ–į—ā—Ä–ł—Ź –ł –ī–ł—Ö—Ä–ĺ–ľ–į—ā –ļ–į–Ľ–ł—Ź –ĺ—á–Ķ–Ĺ—Ć –Ņ–ĺ—Ö–ĺ–∂–ł. –°–ĺ–Ľ—Ć –Ĺ–į—ā—Ä–ł—Ź, –ĺ–ī–Ĺ–į–ļ–ĺ, –≤ –ī–≤–į–ī—Ü–į—ā—Ć —Ä–į–∑ –Ľ—É—á—ą–Ķ —Ä–į—Ā—ā–≤–ĺ—Ä—Ź–Ķ—ā—Ā—Ź –≤ –≤–ĺ–ī–Ķ, —á–Ķ–ľ —Ā–ĺ–Ľ—Ć –ļ–į–Ľ–ł—Ź (49 –≥/–Ľ –Ņ—Ä–ł 0 ¬įC) –ł –Ķ—Ď —ć–ļ–≤–ł–≤–į–Ľ–Ķ–Ĺ—ā–Ĺ–į—Ź –ľ–į—Ā—Ā–į —ā–į–ļ–∂–Ķ –ľ–Ķ–Ĺ—Ć—ą–Ķ ‚ÄĒ –Ņ–ĺ—ć—ā–ĺ–ľ—É –ĺ–Ĺ–į —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ —á–į—Ā—ā–ĺ –ł—Ā–Ņ–ĺ–Ľ—Ć–∑—É–Ķ–ľ—č–ľ –≤–Ķ—Č–Ķ—Ā—ā–≤–ĺ–ľ[–ł—Ā—ā–ĺ—á–Ĺ–ł–ļ –Ĺ–Ķ —É–ļ–į–∑–į–Ĺ 2318 –ī–Ĺ–Ķ–Ļ].
–°—Ö–ĺ–∂–Ķ—Ā—ā—Ć—é —Ö—Ä–ĺ–ľ–ĺ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł –ī–ł—Ö—Ä–ĺ–ľ–į—ā–į –Ĺ–į—ā—Ä–ł—Ź —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ł—Ö –ĺ–Ī—Č–Ķ–Ķ —Ā–≤–ĺ–Ļ—Ā—ā–≤–ĺ ‚ÄĒ –ĺ–Ĺ–ł —Ź–≤–Ľ—Ź—é—ā—Ā—Ź —Ā–ł–Ľ—Ć–Ĺ—č–ľ–ł –ĺ–ļ–ł—Ā–Ľ–ł—ā–Ķ–Ľ—Ź–ľ–ł. –ü–ĺ –ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł—é –ļ –ļ–į–Ľ–ł–Ļ–Ĺ–ĺ–Ļ —Ā–ĺ–Ľ–ł, –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č–ľ –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–ĺ–ľ –ī–ł—Ö—Ä–ĺ–ľ–į—ā–į –Ĺ–į—ā—Ä–ł—Ź —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –Ķ–≥–ĺ –Ī–ĺ–Ľ—Ć—ą–į—Ź —Ä–į—Ā—ā–≤–ĺ—Ä–ł–ľ–ĺ—Ā—ā—Ć –≤ –≤–ĺ–ī–Ķ –ł –≤ –Ņ–ĺ–Ľ—Ź—Ä–Ĺ—č—Ö —Ä–į—Ā—ā–≤–ĺ—Ä–ł—ā–Ķ–Ľ—Ź—Ö, –Ĺ–į–Ņ—Ä–ł–ľ–Ķ—Ä –≤ —É–ļ—Ā—É—Ā–Ĺ–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā–Ķ.
–í –ĺ–Ī–Ľ–į—Ā—ā–ł –ĺ—Ä–≥–į–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ā–ł–Ĺ—ā–Ķ–∑–į —ć—ā–ĺ —Ā–ĺ–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł–Ķ –ĺ–ļ–ł—Ā–Ľ—Ź–Ķ—ā –Ī–Ķ–Ĺ–∑–ł–Ľ—č –ł –į–Ľ–Ľ–ł–Ľ—Ć–Ĺ—É—é –≥—Ä—É–Ņ–Ņ—É C‚ÄĒH —Ā–ĺ–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł–Ļ –ī–ĺ –ļ–į—Ä–Ī–ĺ–Ĺ–ł–Ľ—Ć–Ĺ—č—Ö –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī–Ĺ—č—Ö. –Ę–į–ļ, –Ĺ–į–Ņ—Ä–ł–ľ–Ķ—Ä, 2,4,6-—ā—Ä–ł–Ĺ–ł—ā—Ä–ĺ—ā–ĺ–Ľ—É–ĺ–Ľ –ĺ–ļ–ł—Ā–Ľ—Ź–Ķ—ā—Ā—Ź –ī–ĺ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤—É—é—Č–ł—Ö –ļ–į—Ä–Ī–ĺ–Ĺ–ĺ–≤—č—Ö —Ā–ĺ–Ľ–Ķ–Ļ. –ö—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, 2,3-–ī–ł–ľ–Ķ—ā–ł–Ľ–Ĺ–į—Ą—ā–į–Ľ–ł–Ĺ (–į–Ĺ–≥–Ľ. 2,3-dimethylnaphthalene) –ĺ–ļ–ł—Ā–Ľ—Ź–Ķ—ā—Ā—Ź –≤ –Ņ—Ä–ł—Ā—É—ā—Ā—ā–≤–ł–ł Na2Cr2O7 –ī–ĺ 2,3-–Ĺ–į—Ą—ā–ł–Ľ–ī–ł–ļ–į—Ä–Ī–ĺ–Ĺ–ĺ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č (–į–Ĺ–≥–Ľ. 2,3-naphthalenedicarboxylic acid).
–í –ļ–ł—Ā–Ľ–ĺ–Ļ —Ā—Ä–Ķ–ī–Ķ –≤–ĺ—Ā—Ā—ā–į–Ĺ–į–≤–Ľ–ł–≤–į–Ķ—ā—Ā—Ź –ī–ĺ —Ā–ĺ–Ľ–Ķ–Ļ —Ö—Ä–ĺ–ľ–į(III)[–ł—Ā—ā–ĺ—á–Ĺ–ł–ļ –Ĺ–Ķ —É–ļ–į–∑–į–Ĺ 1142 –ī–Ĺ—Ź]. –Ě–į–Ņ—Ä–ł–ľ–Ķ—Ä, –ĺ–Ĺ –ĺ–ļ–ł—Ā–Ľ—Ź–Ķ—ā –≥–į–Ľ–ĺ–≥–Ķ–Ĺ–ł–ī-–ł–ĺ–Ĺ—č –≥–į–Ľ–ĺ–≥–Ķ–Ĺ–≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ—č—Ö –ļ–ł—Ā–Ľ–ĺ—ā –ī–ĺ —Ā–≤–ĺ–Ī–ĺ–ī–Ĺ—č—Ö –≥–į–Ľ–ĺ–≥–Ķ–Ĺ–ĺ–≤:

–Ę–į–ļ–∂–Ķ –≤ –ļ–ł—Ā–Ľ–ĺ–Ļ —Ā—Ä–Ķ–ī–Ķ –Ņ—Ä–ł pH 3,0‚ÄĒ3,5 –ĺ–Ī–Ľ–į–ī–į–Ķ—ā —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā—Ć—é –ĺ–ļ–ł—Ā–Ľ—Ź—ā—Ć –ľ–Ķ—ā–į–Ľ–Ľ–ł—á–Ķ—Ā–ļ–ĺ–Ķ —Ā–Ķ—Ä–Ķ–Ī—Ä–ĺ[1]:

–ö—Ä–ł—Ā—ā–į–Ľ–Ľ–ł—á–Ķ—Ā–ļ–ł–Ļ –ī–ł—Ö—Ä–ĺ–ľ–į—ā –Ĺ–į—ā—Ä–ł—Ź –Ņ—Ä–ł –Ĺ–į–≥—Ä–Ķ–≤–į–Ĺ–ł–ł —Ā —Ā–Ķ—Ä–ĺ–Ļ –ł —É–≥–Ľ–Ķ—Ä–ĺ–ī–ĺ–ľ –≤–ĺ—Ā—Ā—ā–į–Ĺ–į–≤–Ľ–ł–≤–į–Ķ—ā—Ā—Ź –ī–ĺ –ĺ–ļ—Ā–ł–ī–į —Ö—Ä–ĺ–ľ–į(III)[–ł—Ā—ā–ĺ—á–Ĺ–ł–ļ –Ĺ–Ķ —É–ļ–į–∑–į–Ĺ 1142 –ī–Ĺ—Ź]:


–í–ĺ–ī–Ĺ—č–Ķ —Ä–į—Ā—ā–≤–ĺ—Ä—č –ī–ł—Ö—Ä–ĺ–ľ–į—ā–į –Ĺ–į—ā—Ä–ł—Ź –ĺ–Ī–Ľ–į–ī–į—é—ā –ī—É–Ī—Ź—Č–ł–ľ–ł —Ā–≤–ĺ–Ļ—Ā—ā–≤–į–ľ–ł, –≤ —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł, –∑–į–ī—É–Ī–Ľ–ł–≤–į—é—ā –∂–Ķ–Ľ–į—ā–ł–Ĺ[1].
–ü–ĺ–Ľ—É—á–Ķ–Ĺ–ł–Ķ
–Ē–ł—Ö—Ä–ĺ–ľ–į—ā –Ĺ–į—ā—Ä–ł—Ź –ĺ–Ī—Ä–į–∑—É–Ķ—ā—Ā—Ź –≤ –Ī–ĺ–Ľ—Ć—ą–ł—Ö –ľ–į—Ā—ą—ā–į–Ī–į—Ö –ł–∑ —Ä—É–ī, —Ā–ĺ–ī–Ķ—Ä–∂–į—Č–ł—Ö –ĺ–ļ—Ā–ł–ī —Ö—Ä–ĺ–ľ–į(III).
–°–Ĺ–į—á–į–Ľ–į —Ä—É–ī—É —Ā–Ņ–Ľ–į–≤–Ľ—Ź—é—ā, –ļ–į–ļ –Ņ—Ä–į–≤–ł–Ľ–ĺ, —Ā –ļ–į—Ä–Ī–ĺ–Ĺ–į—ā–ĺ–ľ –Ĺ–į—ā—Ä–ł—Ź –Ņ—Ä–ł —ā–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–Ķ –ĺ–ļ–ĺ–Ľ–ĺ 1000 ¬įC –≤ –Ņ—Ä–ł—Ā—É—ā—Ā—ā–≤–ł–ł –≤–ĺ–∑–ī—É—Ö–į (–ł—Ā—ā–ĺ—á–Ĺ–ł–ļ –ļ–ł—Ā–Ľ–ĺ—Ä–ĺ–ī–į):

–Ě–į –ī–į–Ĺ–Ĺ–ĺ–ľ —ć—ā–į–Ņ–Ķ –ī—Ä—É–≥–ł–Ķ –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā—č —Ä—É–ī—č, —ā–į–ļ–ł–Ķ –ļ–į–ļ –į–Ľ—é–ľ–ł–Ĺ–ł–Ļ –ł –∂–Ķ–Ľ–Ķ–∑–ĺ, –Ņ–Ľ–ĺ—Ö–ĺ —Ä–į—Ā—ā–≤–ĺ—Ä–ł–ľ—č. –ě–ļ–ł—Ā–Ľ–Ķ–Ĺ–ł–Ķ –≤ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ —Ä–Ķ–į–ļ—Ü–ł–ł –≤–ĺ–ī–Ĺ–ĺ–≥–ĺ —ć–ļ—Ā—ā—Ä–į–ļ—ā–į —Ā–Ķ—Ä–Ĺ–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł–Ľ–ł —É–≥–Ľ–Ķ–ļ–ł—Ā–Ľ–ĺ–≥–ĺ –≥–į–∑–į –ī–į—Ď—ā –ī–ł—Ö—Ä–ĺ–ľ–į—ā –Ĺ–į—ā—Ä–ł—Ź, –ļ–ĺ—ā–ĺ—Ä—č–Ļ –≤—č–ī–Ķ–Ľ—Ź–Ķ—ā—Ā—Ź –ļ–į–ļ –ī–ł–≥–ł–ī—Ä–į—ā –Ņ—Ä–ł –ļ—Ä–ł—Ā—ā–į–Ľ–Ľ–ł–∑–į—Ü–ł–ł.
–°–ĺ–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź —Ö—Ä–ĺ–ľ–į(VI) —Ź–≤–Ľ—Ź—é—ā—Ā—Ź —ā–ĺ–ļ—Ā–ł—á–Ĺ—č–ľ–ł, –Ņ–ĺ—ć—ā–ĺ–ľ—É –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–į, –≥–ī–Ķ –ĺ–Ĺ –ĺ–Ī—Ä–į–∑—É–Ķ—ā—Ā—Ź –≤ –≤–ł–ī–Ķ –Ņ—č–Ľ–ł, –ī–ĺ–Ľ–∂–Ĺ—č –Ņ–ĺ–ī—á–ł–Ĺ—Ź—ā—Ć—Ā—Ź —Ā—ā—Ä–ĺ–≥–ł–ľ –Ņ—Ä–į–≤–ł–Ľ–į–ľ –Ņ—Ä–ĺ–ľ—č—ą–Ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ī–Ķ–∑–ĺ–Ņ–į—Ā–Ĺ–ĺ—Ā—ā–ł. –Ě–į–Ņ—Ä–ł–ľ–Ķ—Ä, —á—ā–ĺ–Ī—č —Ā–Ĺ–ł–∑–ł—ā—Ć –Ķ–≥–ĺ —ā–ĺ–ļ—Ā–ł—á–Ĺ–ĺ—Ā—ā—Ć, –Ķ–≥–ĺ —Ā–Ľ–ł–≤–į—é—ā –≤ —Ā—ā–ĺ—á–Ĺ—č–Ķ –≤–ĺ–ī—č, –≥–ī–Ķ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–ī–ł—ā –≤–ĺ—Ā—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ł–Ķ —Ā –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–ł–Ķ–ľ —Ö—Ä–ĺ–ľ–į(III), –ļ–ĺ—ā–ĺ—Ä—č–Ļ –ľ–Ķ–Ĺ–Ķ–Ķ –ĺ–Ņ–į—Ā–Ķ–Ĺ –ī–Ľ—Ź –ĺ–ļ—Ä—É–∂–į—é—Č–Ķ–Ļ —Ā—Ä–Ķ–ī—č.
–ė—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ
–ė—Ā–Ņ–ĺ–Ľ—Ć–∑—É—é—ā –Ņ—Ä–ł –ī—É–Ī–Ľ–Ķ–Ĺ–ł–ł –ļ–ĺ–∂ –ł –≤ —ć–Ľ–Ķ–ļ—ā—Ä–ł—á–Ķ—Ā–ļ–ł—Ö —ć–Ľ–Ķ–ľ–Ķ–Ĺ—ā–į—Ö, –ļ–į–ļ –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā –Ī–ł–ĺ–∑–į—Č–ł—ā–Ĺ—č—Ö —Ā–ĺ—Ā—ā–į–≤–ĺ–≤ –ī–Ľ—Ź –ī—Ä–Ķ–≤–Ķ—Ā–ł–Ĺ—č.
–ě–Ņ–į—Ā–Ĺ–ĺ—Ā—ā—Ć –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź

–ö–į–ļ –ł –≤—Ā–Ķ —Ā–ĺ–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź —ą–Ķ—Ā—ā–ł–≤–į–Ľ–Ķ–Ĺ—ā–Ĺ–ĺ–≥–ĺ —Ö—Ä–ĺ–ľ–į, –ī–ł—Ö—Ä–ĺ–ľ–į—ā –Ĺ–į—ā—Ä–ł—Ź –ĺ—á–Ķ–Ĺ—Ć —ā–ĺ–ļ—Ā–ł—á–Ķ–Ĺ. –ö—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, –ĺ–Ĺ –ł–∑–≤–Ķ—Ā—ā–Ĺ—č–Ļ –ļ–į–Ĺ—Ü–Ķ—Ä–ĺ–≥–Ķ–Ĺ. –í–Ķ—Č–Ķ—Ā—ā–≤–ĺ –ĺ—á–Ķ–Ĺ—Ć —ā–ĺ–ļ—Ā–ł—á–Ĺ–ĺ –ī–Ľ—Ź –≤–ĺ–ī–Ĺ—č—Ö –ĺ—Ä–≥–į–Ĺ–ł–∑–ľ–ĺ–≤, –ľ–ĺ–∂–Ķ—ā –≤—č–∑–≤–į—ā—Ć –ī–ĺ–Ľ–≥–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –≤ –≤–ĺ–ī–Ĺ–ĺ–Ļ —ć–ļ–ĺ—Ā–ł—Ā—ā–Ķ–ľ–Ķ.
–°–ľ. —ā–į–ļ–∂–Ķ
–ü—Ä–ł–ľ–Ķ—á–į–Ĺ–ł—Ź
–õ–ł—ā–Ķ—Ä–į—ā—É—Ä–į
- –†–Ķ–ī—Ć–ļ–ĺ –ź. –í. –•–ł–ľ–ł—Ź —Ą–ĺ—ā–ĺ–≥—Ä–į—Ą–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–ĺ–≤. ‚ÄĒ –°–ü–Ī. : –Ě–ü–ě "–ü—Ä–ĺ—Ą–Ķ—Ā—Ā–ł–ĺ–Ĺ–į–Ľ", 2006. ‚ÄĒ 1464 —Ā. ‚ÄĒ (–Ě–ĺ–≤—č–Ļ —Ā–Ņ—Ä–į–≤–ĺ—á–Ĺ–ł–ļ —Ö–ł–ľ–ł–ļ–į –ł —ā–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–į / —Ä–Ķ–ī. –ú–ĺ—Ā–ļ–≤–ł–Ĺ –ź. –í. ; –≤—č–Ņ. –ě–Ī—Č–ł–Ķ —Ā–≤–Ķ–ī–Ķ–Ĺ–ł—Ź. –°—ā—Ä–ĺ–Ķ–Ĺ–ł–Ķ –≤–Ķ—Č–Ķ—Ā—ā–≤–į. –§–ł–∑–ł—á–Ķ—Ā–ļ–ł–Ķ —Ā–≤–ĺ–Ļ—Ā—ā–≤–į –≤–į–∂–Ĺ–Ķ–Ļ—ą–ł—Ö –≤–Ķ—Č–Ķ—Ā—ā–≤. –ź—Ä–ĺ–ľ–į—ā–ł—á–Ķ—Ā–ļ–ł–Ķ —Ā–ĺ–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź. –•–ł–ľ–ł—Ź —Ą–ĺ—ā–ĺ–≥—Ä–į—Ą–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–ĺ–≤. –Ě–ĺ–ľ–Ķ–Ĺ–ļ–Ľ–į—ā—É—Ä–į –ĺ—Ä–≥–į–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö —Ā–ĺ–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł–Ļ. –Ę–Ķ—Ö–Ĺ–ł–ļ–į –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–Ĺ—č—Ö —Ä–į–Ī–ĺ—ā. –ě—Ā–Ĺ–ĺ–≤—č —ā–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł.). ‚ÄĒ ISBN 978-5-91259-013-9.
–°—Ā—č–Ľ–ļ–ł