Evaporação
|
Read other articles:

الكنيسة اللوثرية، القدسالتسميةنسبة الاسم إلى يسوع معلومات عامةنوع المبنى كنيسة بناء ديني[1] العنوان מתחם המוריסטן (بالعبرية) المنطقة الإدارية القدس[1] البلد إسرائيل الديانة لوثرية — الكنيسة الإنجيلية في ألمانيا أبرز الأحداثالافتتاح الرسمي 1898[1] التصميم وا...

Ben KingsleyKingsley at the 2008 Tribeca Film FestivalLahirKrishna Pandit Bhanji31 Desember 1943 (umur 80)Snainton, Scarborough, Yorkshire, EnglandPekerjaanActorTahun aktif1966–presentSuami/istriAngela Morant (1966–1972)Alison Sutcliffe (1978–1992)Alexandra Christmann (2003–2005)Daniela Lavender (2007–sekarang) Ben Kingsley Sir Ben Kingsley (lahir 31 Desember 1943) adalah seorang pemeran pria berkebangsaan Inggris yang dilahirkan dengan nama Khrisna Branji. Dia memenangka...

Cet article concerne la ville du Kazakhstan. Pour le cosmodrome de Baïkonour, voir Cosmodrome de Baïkonour. Pour la station de métro d’Almaty, voir Baïkonour (métro d'Almaty). Pour le film de 2011, voir Baikonur (film, 2011). Baïkonour Héraldique Drapeau Baïkonour vue d'avion. Administration Pays Kazakhstan Russie Oblys Qızılorda Géographie Coordonnées 45° 37′ 42″ nord, 63° 18′ 16″ est Localisation Géolocalisation sur la carte :...

Television station in Mogi das Cruzes, BrazilTV dos Trabalhadores (ZYB 920)São Bernardo do CampoMogi das CruzesBrazilCitySão Bernardo do CampoChannelsAnalog: 46 (2010-2017)44 (São Paulo)Digital: 44 UHFVirtual: 44ProgrammingLanguage(s)PortugueseOwnershipOwnerFundação Sociedade Comunicação, Cultura e TrabalhoSister stationsRádio Brasil AtualHistoryFoundedAugust 23, 2010; 13 years ago (2010-08-23)Former channel number(s)46 (analog, 2010–2017)Former affiliationsTV Bras...

Si ce bandeau n'est plus pertinent, retirez-le. Cliquez ici pour en savoir plus. Cet article ne cite pas suffisamment ses sources (décembre 2018). Si vous disposez d'ouvrages ou d'articles de référence ou si vous connaissez des sites web de qualité traitant du thème abordé ici, merci de compléter l'article en donnant les références utiles à sa vérifiabilité et en les liant à la section « Notes et références ». En pratique : Quelles sources sont attendues ?...

Historic house in Iowa, United States United States historic placeVander Veer Park Historic DistrictU.S. National Register of Historic PlacesU.S. Historic district Vander Veer Park fountain is a Civil Works Administration project.Show map of IowaShow map of the United StatesLocationRoughly bounded by Temple Lane, W. Central Park Ave., Brady, High, and Harrison Sts., Davenport, IowaCoordinates41°32′35″N 90°34′28″W / 41.54306°N 90.57444°W / 41.54306; -90.5744...

Sports stadium in Toronto, Canada SkyDome redirects here. For other uses, see SkyDome (disambiguation). Not to be confused with Rogers Arena in Vancouver or Rogers Place in Edmonton. Rogers CentreSkyDome[1][2]Rogers Centre in 2008Rogers CentreLocation in TorontoFormer namesSkyDome (1989–2005)Address1 Blue Jays WayLocationToronto, OntarioCoordinates43°38′29″N 79°23′21″W / 43.64139°N 79.38917°W / 43.64139; -79.38917Public transit Union Stati...

Sheila FitzpatrickLahir04 Juni 1941 (umur 82)Melbourne, AustraliaPekerjaanSejarawan, AkademisiKebangsaanAustraliaKewarganegaraanAustraliaAmerika SerikatAlmamaterUniversitas MelbourneSt Antony's College, OxfordLondon School of Slavonic and East European StudiesGenreSejarahTemaUni SovietAliran sastraRevisionisme sejarahPenghargaanMellon Foundation AwardKerabatBrian FitzpatrickWebsitesydney.edu.au/arts/history/staff/profiles/sheila.fitzpatrick.php Sheila Fitzpatrick (lahir 4 Juni 1941)...

We Are Never Ever Getting Back TogetherSingel oleh Taylor Swiftdari album RedDirilis13 Agustus 2012FormatCD single, digital downloadDirekam2012 Conway Studios (Los Angeles, California) MXM Studios (Stockholm, Sweden) MixStar Studio (Virginia Beach, Virginia) Sterling Sound (New York, New York)GenrePop, CountryDurasi3:13LabelBig Machine RecordsPenciptaTaylor Swift, Max Martin, ShellbackProduserMax Martin, Shellback, Dann Huff We Are Never Ever Getting Back Together adalah lagu yang direkam ole...

この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。出典を追加して記事の信頼性向上にご協力ください。(このテンプレートの使い方)出典検索?: コルク – ニュース · 書籍 · スカラー · CiNii · J-STAGE · NDL · dlib.jp · ジャパンサーチ · TWL(2017年4月) コルクを打ち抜いて作った瓶の栓 コルク(木栓、�...

Indonesian vegetable dish PecelAlternative namesPecalPlace of originIndonesiaRegion or statePonorogo, Madiun, Ngawi, Yogyakarta, Central Java, East JavaServing temperatureRoom temperatureMain ingredientsVegetables in peanut sauce Media: Pecel Pecel (Indonesian pronunciation: [pət͡ʃəl], Javanese:ꦥꦼꦕꦼꦭ꧀) is a traditional Javanese salad with peanut sauce,[1] usually eaten with carbs (steamed rice, lontong or ketupat).[2][3] The simplicity...

Jazz tradizionale Humphrey Lyttelton suona la trombaOrigini stilisticheJazz Strumenti tipici trombe tromboni clarinetti banjo contrabbassi batterie chitarre elettriche organi a canne sassofoni bassi elettrici pianoforti organi elettrici Categorie correlateGruppi musicali jazz · Musicisti jazz · Album jazz · EP jazz · Singoli jazz · Album video jazz Il Jazz tradizionale (In inglese Trad jazz), è una forma di jazz nata negli Stati Uniti e in Gran Bretagna che fiorì da...

Questa voce sull'argomento calciatori italiani è solo un abbozzo. Contribuisci a migliorarla secondo le convenzioni di Wikipedia. Segui i suggerimenti del progetto di riferimento. Rocco Cotroneo Rocco Cotroneo con la maglia dell'Empoli (1987) Nazionalità Italia Altezza 170 cm Peso 65 kg Calcio Ruolo Allenatore (ex centrocampista) Termine carriera 1997 - giocatore CarrieraSquadre di club1 1978-1979 Roccella Jonica? (?)1979-1980 Reggina1 (0)1980-1981 Omegna28 (1)1981-198...

League of Ireland 20232023 SSE Airtricity League Premier Division Competizione League of Ireland Premier Division Sport Calcio Edizione 103ª Organizzatore FAI Date dal 17 febbraio 2023al 3 novembre 2023 Luogo Irlanda Partecipanti 10 Formula Girone all'italiana Risultati Vincitore Shamrock Rovers(21º titolo) Retrocessioni Cork CityUCD Statistiche Miglior marcatore Jack MoylanJonathan Afolabi Incontri disputati 119 Gol segnati 310 (2,61 per incontro) Cronologia della ...

List of events in the year 1403 ← 1402 1401 1400 1399 1398 1403 in Ireland → 1404 1405 1406 1407 1408 Centuries: 13th 14th 15th 16th 17th Decades: 1380s 1390s 1400s 1410s 1420s See also:Other events of 1403List of years in Ireland Events from the year 1403 in Ireland. Incumbent Lord: Henry IV Events Tadhg Ruadh Ó Cellaigh succeeded Conchobar an Abaidh Ó Cellaigh as King of Hy-Many in present-day counties Galway and Roscommon. Maolmhordha mac Con Connacht succeeds Giolla Iosa mac...

Ця стаття потребує додаткових посилань на джерела для поліпшення її перевірності. Будь ласка, допоможіть удосконалити цю статтю, додавши посилання на надійні (авторитетні) джерела. Зверніться на сторінку обговорення за поясненнями та допоможіть виправити недоліки. Мат...

Connie StevensStevens pada 1960anLahirConcetta Rosalie Ann Ingoglia08 Agustus 1938 (umur 85)Brooklyn, New York, ASPekerjaanAktris, sutradara, penulis naskah, produser, sinematografer, penyunting, penyanyiTahun aktif1955–sekarangSuami/istriJames Stacy (m. 1963; bercerai 1966) Eddie Fisher (m. 1967; bercerai 1969)AnakJoely FisherTricia Leigh Fisher Connie Stevens (nama lahir Conc...

Lower house of the state legislature of Minnesota, US Minnesota House of Representatives93rd Minnesota LegislatureTypeTypeLower house of the Minnesota Legislature Term limitsNoneHistoryNew session startedJanuary 3, 2023 (2023-01-03)LeadershipSpeakerMelissa Hortman (DFL) since January 8, 2019 Speaker pro temporeDan Wolgamott (DFL) since January 3, 2023 Majority LeaderJamie Long (DFL) since January 3, 2023 Minority LeaderLisa Demuth (R) since January 3, 2023 StructureSeats134Poli...
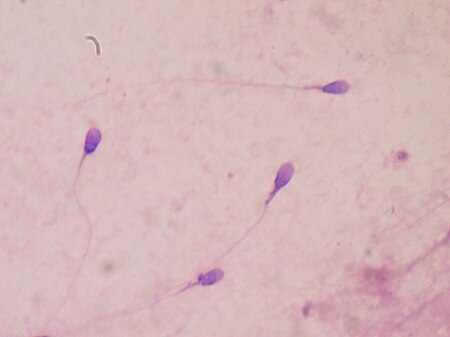
Sperma manusia Kompetisi sperma adalah proses persaingan antara spermatozoa dua jantan atau lebih dalam membuahi sel telur yang sama.[1] Persaingan dapat terjadi jika betina memiliki lebih dari satu pasangan potensial. Pilihan yang lebih beragam meningkatkan kesempatan betina dalam menghasilkan keturunan yang lebih bugar.[2] Namun, dengan banyaknya pasangan potensial, kesempatan masing-masing jantan dalam menghasilkan keturunan juga berkurang, sehingga kompetisi sperma menjadi...

1987 TV series or program Hoover vs. The KennedysGenreHistorical dramaWritten byMichael O'HerlihyLionel E. SiegeNo. of episodes4ProductionProducersPaul SaltzmanDaniel SelznickJoe GlickmanProduction locationsToronto, OntarioProduction companyOperation Prime TimeOriginal releaseRelease1987 (1987) Hoover vs. The Kennedys: The Second Civil War is a four-hour 1987 made-for-television mini-series depicting the political struggles between FBI Director J. Edgar Hoover and President John F. Kenne...








