Stœchiométrie
|
Read other articles:
Frank ThringThring saat pengambilan gambar dari film King of KingsLahirFrank William Thring(1926-05-11)11 Mei 1926Melbourne, Victoria, AustraliaMeninggal29 Desember 1994(1994-12-29) (umur 68)Melbourne, Victoria, AustraliaPekerjaanPemeranSuami/istriJoan Cunliffe (bercerai) Frank William Thring (11 Mei 1926 – 29 Desember 1994) adalah seorang pemeran radio, panggung, televisi dan film asal Australia.[1] Masa kecil Thring lahir di Melbourne, putra dari pasangan Frank...

250ox Howard DGA-3 Pete, alias Damned Good Airplane - 3, Baker Special, dan Little Audrey adalah pesawat terbang ketiga yang dibangun oleh Ben Howard, dan yang pertama dalam serangkaian pesawat balap. Howard mengklaim kapal itu begitu cepat dari penggunaan nya Go Grease. Referensi Wikimedia Commons memiliki media mengenai Howard DGA-3.

EW1 Stasiun MRT Pasir Ris巴西立地铁站பாசிர் ரிஸ்Peron Stasiun MRT Pasir Ris.Lokasi10 Pasir Ris CentralSingapura 519634Koordinat1°22′20.68″N 103°56′57.73″E / 1.3724111°N 103.9493694°E / 1.3724111; 103.9493694Jalur Jalur Timur Barat Jumlah peronPulauJumlah jalur2LayananBis, TaxiKonstruksiJenis strukturMelayangTinggi peron2Akses difabelYesInformasi lainKode stasiunEW1SejarahDibuka16 Desember 1989Operasi layanan S...

Fairfield adalah sebuah kota di Franklin County, Vermont, Amerika Serikat yang berpenduduk sekitar 1800 jiwa (2000). Tokoh terkenal Chester Alan Arthur, presiden AS Bradley Barlow, anggota DPR John Fitzpatrick, wali kota New Orleans Charles Shattuck Hill, penyunting Artikel bertopik geografi atau tempat Amerika Serikat ini adalah sebuah rintisan. Anda dapat membantu Wikipedia dengan mengembangkannya.lbs

PT Screenplay Bumilangit ProduksiNama dagangScreenplay BumilangitJenisPerseroan terbatasIndustriPerfilmanDidirikan2018; 6 tahun lalu (2018) di Jakarta, IndonesiaPendiri Bismarka Kurniawan Wicky V. Olindo KantorpusatSCTV Tower, Senayan City, Jl. Asia Afrika Lot 19, Gelora, Tanah Abang, Jakarta Pusat, IndonesiaWilayah operasiIndonesiaTokohkunci Bismarka Kurniawan Wicky V. Olindo Joko Anwar Pemilik Screenplay Films Bumilangit Studio Situs webscreenplaybumilangit.com PT Screenplay Bumilangit...

For the 2017 film, see Shubh Mangal Saavdhan. This article has multiple issues. Please help improve it or discuss these issues on the talk page. (Learn how and when to remove these template messages) This article may rely excessively on sources too closely associated with the subject, potentially preventing the article from being verifiable and neutral. Please help improve it by replacing them with more appropriate citations to reliable, independent, third-party sources. (March 2013) (Learn h...

「俄亥俄」重定向至此。关于其他用法,请见「俄亥俄 (消歧义)」。 俄亥俄州 美國联邦州State of Ohio 州旗州徽綽號:七葉果之州地图中高亮部分为俄亥俄州坐标:38°27'N-41°58'N, 80°32'W-84°49'W国家 美國加入聯邦1803年3月1日,在1953年8月7日追溯頒定(第17个加入联邦)首府哥倫布(及最大城市)政府 • 州长(英语:List of Governors of {{{Name}}}]]) •&...
2020年夏季奥林匹克运动会波兰代表團波兰国旗IOC編碼POLNOC波蘭奧林匹克委員會網站olimpijski.pl(英文)(波兰文)2020年夏季奥林匹克运动会(東京)2021年7月23日至8月8日(受2019冠状病毒病疫情影响推迟,但仍保留原定名称)運動員206參賽項目24个大项旗手开幕式:帕维尔·科热尼奥夫斯基(游泳)和马娅·沃什乔夫斯卡(自行车)[1]闭幕式:卡罗利娜·纳亚(皮划艇)&#...
Lee Jong SukLahir14 September 1989 (umur 34)Kebangsaan Korea SelatanPendidikanUniversitas KonkukPekerjaanAktor, modelTahun aktif2005–sekarangAgenA-Man Project (2018-kini)Nama KoreaHangul이종숙 Hanja李鍾碩 Alih AksaraI Jong-seokMcCune–ReischauerYi Chongsŏk Situs weblee-jongsuk.com Lee Jong Suk (Hangul: 이종석 ; lahir 14 September 1989)[1] adalah aktor dan model asal Korea Selatan. Dia memulai debutnya pada tahun 2005 dengan film pendek Sympathy. Ia le...

African Union's space organisation African Space AgencyAgency overviewFormed24 January 2023; 16 months ago (2023-01-24)TypeSpace agencyJurisdictionAfrican UnionStatusActiveHeadquartersNew Cairo, Egypt Politics of the African Union Institutions Casablanca Group Union of African States Organisation of African Unity African Economic Community African Unification Front Executive Assembly Chairperson Commission Chairperson Conference and Events Peace & Sec. Pol. Affairs Infra...

جزء من سلسلة حولالتمييز أشكال عامة عمر طائفة طبقة لون إعاقة نمط وراثي شعر طول لغة مظهر سمات عقلية عرق / أثنية / جنسية رتبة دين جنس توجه جنسي حجم أنواع أشكال محددة اجتماعية رهاب اللاجنسية وصمة عار الإيدز سلطة البالغين اضطهاد المصابين بالمهق معاداة التشرد معاداة الم�...
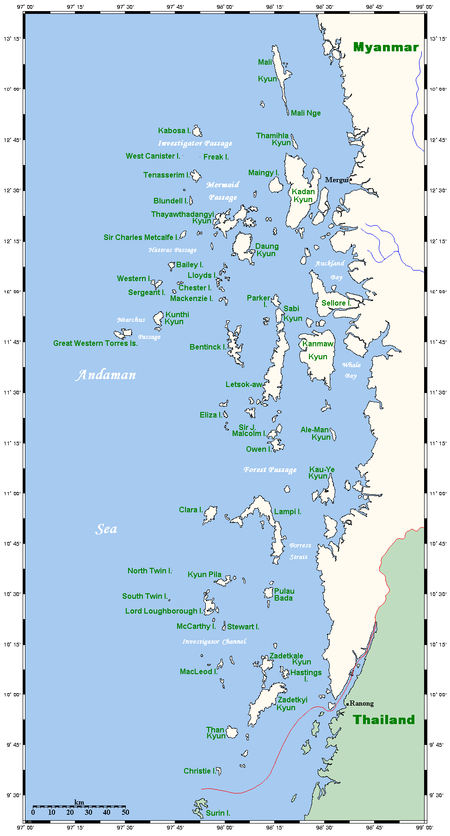
Kepulauan di perbatasan Thailand dan Myanmar yang terdiri dari 800 gugus pulau Kepulauan adalah rantai, gugusan, atau kumpulan dari pulau-pulau yang terbentuk secara tektonik. Kata archipelago dalam bahasa Inggris berasal dari bahasa Yunani ἄρχι- - arkhi- (kepala) dan πέλαγος - pelagos (laut) yang berasal dari rekonstruksi linguistik bahasa Yunani abad pertengahan ἀρχιπέλαγος tepatnya nama untuk Laut Aegea, kemudian bergeser untuk merujuk pada Kepulauan Aegea atau meru...

2-Oktuna Nama Nama IUPAC (preferensi) Okt-2-una Nama lain Amilmetilasetilena; Metilpentilasetilena Penanda Nomor CAS 2809-67-8 Y Model 3D (JSmol) Gambar interaktif 3DMet {{{3DMet}}} ChemSpider 16791 Nomor EC PubChem CID 17769 Nomor RTECS {{{value}}} UNII YP28K987X2 Y CompTox Dashboard (EPA) DTXSID10182366 InChI InChI=1S/C8H14/c1-3-5-7-8-6-4-2/h3,5,7-8H2,1-2H3Key: QCQALVMFTWRCFI-UHFFFAOYSA-NInChI=1/C8H14/c1-3-5-7-8-6-4-2/h3,5,7-8H2,1-2H3Key: QCQALVMFTWRCFI-UHFFFAOYAD SMILE...

توزيع قوة الفرملة إلكترونيًا (بالإنجليزية: Electronic brakeforce distribution) ويختصر إلى EBD وهي تقنية فرملة في السيارات تغير آليا كمية القوة المطبقة على كل من مكابح السيارة وفقًا لظروف الطريق والسرعة والحمولة، إلخ. ويمكن لنظام EBD باقترانه الدائم مع نظام الكوابح المانع للانزلاق (ABS) بتطب�...

سيفيل الإحداثيات 41°00′56″N 81°51′52″W / 41.0156°N 81.8644°W / 41.0156; -81.8644 [1] سبب التسمية إشبيلية تقسيم إداري البلد الولايات المتحدة[2][3] التقسيم الأعلى مقاطعة مدينا خصائص جغرافية المساحة 6.741683 كيلومتر مربع6.740477 كيلومتر مربع (1 أبريل 2010)...

The Times Portada de The Times del 4 de diciembre de 1788Tipo DiarioFormato Tabloide (lunes a sábado)Gran formato (domingo)País Reino Unido Reino UnidoSede Wapping, LondresFundación 1 de enero de 1785 (239 años)Fundador(a) John WalterIdeología política Centro derechaConservadurismo liberalIdioma InglésPrecio £0,90 (lunes a viernes)£2 (sábado) £1,30 (sábado, Escocia)Frecuencia diariaCirculación 502 436Propietario(a) News UKEditor(a) James HardingISSN 0140-0460Sitio web w...

Club Can't Handle MeSingel oleh Flo Rida featuring David Guettadari album Only One Flo (Part 1) dan Step Up 3DSisi-BFresh I StayDirilis28 Juni 2010 (2010-06-28)GenreHip houseDurasi3:52LabelAtlanticPenciptaTramar DillardCarmen KeyKasia LivingstonMike CarenDavid GuettaFrédéric RiestererGiorgio TuinfortProduserDavid GuettaFrédéric RiestererKronologi singel Flo Rida Feel It (2010) Club Can't Handle Me (2010) iYiYi (2010) Kronologi singel David Guetta Commander(2010) Club Can't ...

Australia ai XXI Giochi olimpici invernaliVancouver 2010 Codice CIOAUS Comitato nazionaleAOC Atleti partecipanti38 in 11 discipline PortabandieraTorah Bright[1] Medagliere Posizione 13ª 2 1 0 3 Cronologia olimpica (sommario)Giochi olimpici estivi 1896 · 1900 · 1904 · 1908* · 1912* · 1920 · 1924 · 1928 · 1932 · 1936 · 1948 · 1952 · 1956 · 1960 · 1964 · 1968 · 1972 · 197...

Куберасанскр. कुबेर Мифология индийская Пол мужской Отец Вишрава Мать Илавида Супруга Бхадра Дети Налакувара и Манибхадра Вахана кабан Мантра Om Shreem Om Hreem Shreem Hreem Kleem Shreem Kleem Vitteswaraaya Namah Медиафайлы на Викискладе Запрос «Вайшравана» перенаправляется сюда. На эту т�...

Turkish politician (1888–1963) Hatice Sabiha GörkeyGörkey (1935)Deputy of SivasIn office9 February 1935 – 26 March 1939 Personal detailsBornHatice Sabiha1888 (1888)Üsküdar, Istanbul, Ottoman EmpireDied22 November 1963(1963-11-22) (aged 74–75)NationalityTurkishPolitical partyRepublican People's Party (CHP)EducationTeacher educationAlma materIstanbul Teacher's College, Istanbul UniversityOccupationPoliticianProfessionHeadteacher and Mathematics teacher of Girls's Se...












