|
Yoduro de bismuto
Yoduro de bismuto |
|---|
![]() |
 |
 | | Nombre IUPAC |
|---|
|
Bismuth(III) iodide | | General |
|---|
| Otros nombres |
Bismuth iodide, bismuth triiodide |
|---|
| Fórmula molecular |
BiI3 |
|---|
| Identificadores |
|---|
| Número CAS |
7787-64-6[1] |
|---|
| ChemSpider |
21172753 |
|---|
| PubChem |
24860889 |
|---|
| UNII |
BGX9X3FOLL |
|---|
|
|
InChI= InChI=1S/C25H32F3NO2/c1-17(2)5-11-22(12-6-18(3)4)29-14-13-19(16-24(30)31)15-23(29)20-7-9-21(10-8-20)25(26,27)28/h7-10,18-19,22-23H,1,6,12-16H2,2-4H3,(H,30,31)/t19-,22-,23+/m1/s1Key: NIEMQBKCYCTFEI-PTUXOGIPSA-N | | Propiedades físicas |
|---|
| Apariencia |
cristales verde-negruzcos |
|---|
| Densidad |
5,778 kg/m³; 0,005778 g/cm³ |
|---|
| Masa molar |
589.69 g/mol g/mol |
|---|
| Punto de fusión |
681,8 K (409 °C) |
|---|
| Punto de ebullición |
815 K (542 °C) |
|---|
Valores en el SI y en condiciones estándar
(25 ℃ y 1 atm), salvo que se indique lo contrario. | |
Yoduro de bismuto es el compuesto inorgánico. Este sólido de color gris-negro es el producto de la reacción de bismuto y yodo, que una vez fue de interés en el análisis cualitativo inorgánico.[2]
[3]
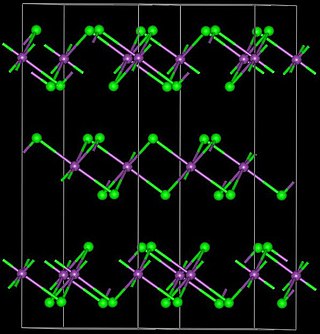
Yoduro de bismuto adopta una estructura de cristal distintivo, con centros de yoduro ocupando un hexagonal empaquetado, más cercano de celosía, y centros de bismuto ocupando ya sea ninguno o dos tercios de los huecos octaédricos (alternando por capa), por lo que se dice que ocupa un tercio de los agujeros octaédricos totales.[4]
[5][6]
Síntesis
Yoduro de bismuto se forma de calentamiento de una mezcla íntima de yodo y bismuto en polvo::[7]
- 2Bi + 3I2 → 2BiI3
BiI3 también se puede hacer por la reacción de óxido de bismuto con una solución acuosa de ácido yodhídrico:[8]
- Bi2O3(s) + 6HI(aq) → 2BiI3(s) + 3H2O(l)
Reacciones
Yoduro de bismuto es insoluble en agua, una solución acuosa se puede probar para la presencia de Bi 3+ iones mediante la adición de una fuente de yoduro, tal como yoduro de potasio. Un precipitado negro de yoduro de bismuto indica una prueba positiva.[9]
- 2 NaI + BiI3 → Na2[BiI5]
Referencias
- ↑ Número CAS
- ↑
«Bismuth iodide», McGraw-Hill Dictionary of Scientific and Technical Terms, McGraw-Hill, 2003, consultado el 19 de junio de 2008 .
- ↑
Turner, Jr., Francis M.; Berolzheimer, Daniel D.; Cutter, William P.; Helfrich, John (1920), The Condensed Chemical Dictionary, New York: Chemical Catalog Company, p. 107, consultado el 19 de junio de 2008 .
- ↑
Smart, Lesley; Moore, Elaine A. (2005), Solid State Chemistry: An Introduction, CRC Press, p. 40, ISBN 0-7487-7516-1, consultado el 19 de junio de 2008 .
- ↑
Mackay, Rosemary Ann; Henderson, W. (2002), Introduction to Modern Inorganic Chemistry, CRC Press, pp. 122-6, ISBN 0-7487-6420-8, consultado el 19 de junio de 2008 .
- ↑ Norman, Nicholas C. (1998), Chemistry of Arsenic, Antimony and Bismuth, Springer, p. 95, ISBN 0-7514-0389-X, consultado el 3 de junio de 2008 .
- ↑ Erdmann, Hugo; Dunlap, Frederick Leavy (1900), Handbook of Basic Tables for Chemical Analysis, New York: John Wiley & Sons, p. 76, consultado el 19 de junio de 2008 .
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 559. ISBN 0080379419.
- ↑
Bruno, Thomas J.; Svoronos, Paris D. N. (2003), Handbook of Basic Tables for Chemical Analysis, CRC Press, p. 549, ISBN 0-8493-1573-5, consultado el 19 de junio de 2008 .
Enlaces externos
|
|