| Trichlortriazin |
|---|
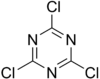 Strukturní vzorec trichlortriazinu |
 Model molekuly trichlortriazinu |
| Obecné |
|---|
| Systematický název | 2,4,6-trichlor-1,3,5-triazin |
|---|
| Ostatní názvy | kyanurylchlorid, trichlorkyan, kyanurchlorid, cyanurchlorid |
|---|
| Anglický název | Cyanuric chloride |
|---|
| Německý název | Cyanurchlorid |
|---|
| Sumární vzorec | C3Cl3N3 |
|---|
| Vzhled | bílý prášek |
|---|
| Identifikace |
|---|
| Registrační číslo CAS | 108-77-0 |
|---|
| EC-no (EINECS/ELINCS/NLP) | 203-614-9 |
|---|
| PubChem | 7954 |
|---|
| SMILES | Clc1nc(Cl)nc(Cl)n1 |
|---|
| Číslo RTECS | XZ1400000 |
|---|
| Vlastnosti |
|---|
| Molární hmotnost | 184,41 g/mol |
|---|
| Teplota tání | 154 °C |
|---|
| Teplota varu | 192 °C |
|---|
| Hustota | 1,32 6 g/cm3 |
|---|
| Rozpustnost ve vodě | hydrolyzuje |
|---|
Rozpustnost v nepolárních
rozpouštědlech | rozpustný |
|---|
| Bezpečnost |
|---|
 GHS05 GHS05 GHS06 GHS06 GHS07 GHS07
Nebezpečí[1] |
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa).
|
Trichlortriazin (též kyanurylchlorid, trichlorkyan, kyanurchlorid či cyanurchlorid; systematický název 2,4,6-trichlor-1,3,5-triazin) je anorganická sloučenina se vzorcem (NCCl)3. Tato bezbarvá tuhá látka je chlorovaným derivátem 1,3,5-triazinu. Jedná se o trimer chlorkyanu.[2] Je hlavním prekurzorem populárního, avšak kontroverzního herbicidu atrazinu.
Výroba
Trichlortriazin se vyrábí ve dvou krocích z kyanovodíku přes meziprodukt chlorkyan, který se trimerizuje za zvýšené teploty na uhlíkovém katalyzátoru:
- HCN + Cl2 → ClCN + HCl
- 3 ClCN → (ClCN)3
V roce 2005 se na světě vyrobilo zhruba 200 000 tun.[3]
Průmyslové použití
Odhaduje se, že 70 % trichlortriazinu připadá na použití pro výrobu triazinových pesticidů, zejména atrazinu. Takové reakce jsou založeny na snadné náhradě chloridů nukleofily, například aminy:
- (ClCN)3 + 2 RNH2 → (RNHCN)(ClCN)2 + RNH3+Cl−
Podobně lze vyrábět další triazinové herbicidy, například simazin, anilazin nebo cyromazin.[4]
Trichlortriazin se využívá také jako prekurzor pro barviva a zesíťovací činidla. Největší třída těchto barviv jsou sulfonované triazin-stilbenové optické zjasňovače (OBA) čili fluorescenční bělidla (FWA), často používané v pracích prostředcích a bílém papíře.[3] Triazinový kruh je začleněn také v mnoha reaktivních barvivech. I tato se vyrábějí substitucí chloru jiným radikálem, jako v reakci popsané výše.[4]
Organická syntéza
V jedné specializované aplikace se trichlortriazin využívá jako reagens při konverzi alkoholů a karboxylových kyselin na alkyl-, resp. acylchloridy:[5]
![]()
Využívá se i jako dehydratační činidlo a pro aktivaci karboxylových kyselin při redukci na alkoholy. Zahříváním s dimethylformamidem vzniká Goldovo reagens Me2NCH=NCH=NMe2+Cl−, které je víceúčelovým zdrojem pro aminoalkylace a prekurzorem heterocyklických sloučenin.[6][7]
Chloridová centra lze snadno nahradit aminy za vzniku melaminových derivátů, například v syntéze dendrimerů:[8][9]
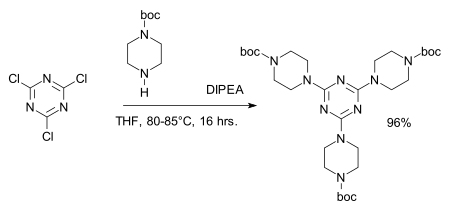
Trichlortriazin se využívá i při syntéze experimentálního ligandu adenosinového receptoru.[10]:

Reference
V tomto článku byl použit překlad textu z článku Cyanuric chloride na anglické Wikipedii.
- ↑ a b Cyanuric chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Cyanuric chloride at Chemicalland21.com
- ↑ a b Klaus Huthmacher, Dieter Most "Cyanuric Acid and Cyanuric Chloride" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a08_191Je zde použita šablona
{{DOI}} označená jako k „pouze dočasnému použití“..
- ↑ a b Ashford's Dictionary of Industrial Chemicals, 3rd edition, 2011, pages 2495-8
- ↑ K. Venkataraman, and D. R. Wagle. Cyanuric chloride : a useful reagent for converting carboxylic acids into chlorides, esters, amides and peptides. Tet. Lett.. 1979, s. 3037–3040. DOI 10.1016/S0040-4039(00)71006-9. Je zde použita šablona
{{Cite journal}} označená jako k „pouze dočasnému použití“.
- ↑ Probst, D. A.; Hanson, P. R.; Barda, D. A. "Cyanuric Chloride" in Encyclopedia of Reagents for Organic Synthesis, 2004, John Wiley & Sons. DOI:10.1002/047084289X.rn00320Je zde použita šablona
{{DOI}} označená jako k „pouze dočasnému použití“.
- ↑ JOHN T. GUPTON; STEVEN A. ANDREWS. β-Dimethylaminomethylenation: N,N-Dimethyl-N'-p-tolylformamidine. Org. Synth.. 1990. Dostupné online. Je zde použita šablona
{{Citation}} označená jako k „pouze dočasnému použití“.; Coll. Vol.. S. 197. Je zde použita šablona {{Citation}} označená jako k „pouze dočasnému použití“.Je zde použita šablona {{OrgSynth}} označená jako k „pouze dočasnému použití“.
- ↑ Abdellatif Chouai and Eric E. Simanek. Kilogram-Scale Synthesis of a Second-Generation Dendrimer Based on 1,3,5-Triazine Using Green and Industrially Compatible Methods with a Single Chromatographic Step. J. Org. Chem.. 2008, s. 2357–2366. DOI 10.1021/jo702462t. PMID 18307354. Je zde použita šablona
{{Cite journal}} označená jako k „pouze dočasnému použití“.
- ↑ Reagent: DIPEA, amine protective group: BOC
- ↑ 1,3,5-TRIAZINE DERIVATIVES AS LIGANDS FOR HUMAN ADENOSINE-A3 RECEPTORS. WO. Patentový spis 03101980. 2003-12-11. (Reagent number two: norephedrine, base DIPEA)
Externí odkazy