Stereospecifita je vlastnost reakčního mechanismu, který způsobuje rozdílné rozdělení stereoizomerů mezi produkty reakce při použití reaktantů s odlišnou stereochemií, případně vznik jen jednoho (nebo jen některých) z možných stereoizomerů.[1][2]
Pojem stereoselektivita[1][2] oproti tomu označuje stav, kdy nestereospecifický mechanismus umožňuje tvorbu více produktů, ovšem jeden z nich, nebo jejich část, je upřednostňována jinými faktory, jako jsou například sterické efekty, nezávislými na mechanismu.
Stereospecifický mechanismus určuje stereochemii produktu vytvořeného z daného reaktantu, zatímco stereoselektivní reakce „vybírá“ produkty mezi několika možnostmi, které dává nespecifický mechanismus. Při použití jedné stereoizomerně čisté výchozí látky stereospecifický mechanismus vytvoří výhradně jeden stereoizomer produktu (nebo nebude reagovat), i když vedlejší mechanismy mohou stereochemii posunout. Stereoselektivní reakcí obvykle vzniká několik produktů i tehdy, když je přítomen jediný mechanismus a použit izomerně čistý výchozí materiál.
Označení stereospecifická reakce je nejednoznačné, protože samotné slovo reakce může označovat přeměnu skrz jediný mechanismus (jako je Dielsova–Alderova reakce), která může být stereospecifická, nebo proces probíhající s několika mechanismy u různých reaktantů různými mechanismy, specifickými i nespecifickými. V druhém případě se někdy pojem stereospecifická reakce nepřesně používá pro označení vysoce stereoselektivních reakcí.
Asymetrická syntéza může zahrnovat stereospecifické (přeměňující již vzniklá stereocentra) i stereoselektivní reakce (sloužící k vytváření nových stereocenter), při nichž je také zachována optická aktivita chemické sloučeniny.
Míra stereospecifity závisí na reaktantech a jejich stereochemiích; vliv na ní mají rovněž produkty, ovšem pouze tím, že poskytují stopy o interakcích mezi reaktanty; každý stereoizomerní reaktant se chová jinak. Stereospecifita vůči enantiomerům se nazývá enantiospecifita.
Příklady
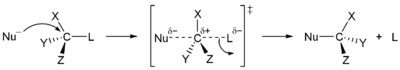
Nukleofilní substituce na sp3 centrech probíhají stereospecifickým SN2 mechanismem, přičemž dochází pouze k obrácení konfigurace, nebo nespecifickým SN1 mechanismem, přičemž i zde může docházet k selektivnímu obrácení konfigurace, v závislosti na reaktantech a podmínkách reakce. Konkrétní mechanismus u daného reaktantu závisí na dalších faktorech, jako jsou sterická dostupnost reakčního centra substrátu, druh nukleofilu, rozpouštědlo a teplota.
| Stereospecifita substitučních reakcí
|

|
|
| SN1 mechanismus, nestereospecifický
|
SN2 mechanismus stereospecifický
|
Terciární centra reagují téměř výhradně SN1 mechanismem, zatímco primární (s výjimkou neopentylových) reagují podle SN2 mechanismu. Pokud při nukleofilní substituci dojde k neúplné změně konfigurace, je to způsobeno současným průběhem vice mechanismů, což je časté u sekundárních center, či dvojnásobnou přeměnou (například když je jako nukleofil použit jodid).
Adice singletových karbenů na alkeny je stereospecifická a geometrie alkenu je u produktu zachována, například reakcí dibromkarbenu a cis-but-2-enu vzniká cis-2,3-dimethyl-1,1-dibromcyklopropan, zatímco při použití trans izomeru se tvoří pouze trans cyklopropan.[3]
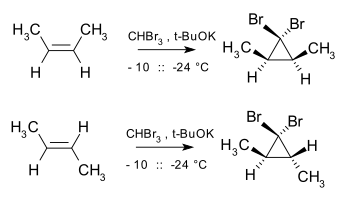
Tato adice zůstává stereospecifickou i tehdy, když výchozí alken není izomerně čistý.
Disrotační uzavírání kruhu u konjugovaných trienů je stereospecifické, protože izomerní reaktanty vytvářejí izomerní produkty, například z trans,cis,trans-2,4,6-oktatrienu vzniká cis-dimethylcyklohexadien, zatímco trans,cis,cis reaktant dává trans produkt a trans,trans,trans izomer tímto způsobem nereaguje.

Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Stereospecificity na anglické Wikipedii.
- ↑ a b Overlap Control of Carbanionoid Reactions. I. Stereoselectivity in Alkaline Epoxidation, Zimmerman, H. E.; Singer, L.; Thyagarajan, B. S. J. Am. Chem. Soc., 1959, 81, 108-116.
- ↑ a b Eliel, E., "Stereochemistry of Carbon Compound", McGraw-Hill, 1962 pp 434-436
- ↑ P. S. Skell; A. Y. Garner. The Stereochemistry of Carbene-Olefin Reactions. Reactions of Dibromocarbene with the cis- and trans-2-Butenes. Journal of the American Chemical Society. 1956, s. 3409–3411. DOI 10.1021/ja01595a040.