Guldbergův–Waagův zákon
|
Read other articles:

Angkatan Udara ChiliFuerza Aérea de ChileLambang Angkatan Udara ChiliDibentuk21 Maret 1930; 93 tahun lalu (1930-03-21)Negara ChiliTipe unitAngkatan udaraPeranPeperangan udaraBagian dariAngkatan Bersenjata Chili Angkatan Udara Chili (Spanyol: Fuerza Aérea de Chile, FACHcode: es is deprecated ) adalah angkatan udara dari Chili, sebuah cabang dari militer Chili. Angkatan Udara Chili menyelenggarakan latihan gabungan Salitre dengan negara-negara sahabat lainnya. Angkatan Udara Chili j...

Artikel ini perlu diterjemahkan ke bahasa Indonesia. Artikel ini ditulis atau diterjemahkan secara buruk dari Wikipedia bahasa selain Indonesia. Jika halaman ini ditujukan untuk komunitas berbahasa tersebut, halaman itu harus dikontribusikan ke Wikipedia bahasa tersebut. Lihat daftar bahasa Wikipedia. Artikel yang tidak diterjemahkan dapat dihapus secara cepat sesuai kriteria A2. Jika Anda ingin memeriksa artikel ini, Anda boleh menggunakan mesin penerjemah. Namun ingat, mohon tidak menyalin ...

2018 Massachusetts general election ← 2016 November 6, 2018 2020 → Part of the2018 United States elections Elections in Massachusetts General 1942 1944 1946 1948 1950 1952 1954 1956 1958 1960 1962 1964 1966 1970 1974 1978 1982 1986 1990 1994 1998 2002 2006 2008 2010 2012 2014 2016 2018 2020 2022 Federal government U.S. President 1788–89 1792 1796 1800 1804 1808 1812 1816 1820 1824 1828 1832 1836 1840 1844 1848 1852 1856 1860 1864 1868 1872 1876 1880 1884 1888 1892 189...

Central drug policy-making body of the UN System Commission on Narcotic DrugsAbbreviationCNDFormation1946; 78 years ago (1946)TypeIntergovernmental organization, Regulatory body, Advisory boardLegal statusActiveHeadquartersVienna International Center, Vienna, AustriaChairpersonRotating every yearParent organizationUN ECOSOCSubsidiariesFINGOVWebsiteCND at UNODC.org Politics portal The Commission on Narcotic Drugs (CND) is one of the functional commissions of the Unit...

Gereja Hati KudusGereja Paroki Hati KudusSacred Heart Church, Raleigh35°46′51″N 78°38′31″W / 35.78083°N 78.64194°W / 35.78083; -78.64194Koordinat: 35°46′51″N 78°38′31″W / 35.78083°N 78.64194°W / 35.78083; -78.64194Lokasi200 Hillsborough St.Raleigh, North CarolinaNegaraAmerika SerikatDenominasiGereja Katolik RomaSitus webhttp://www.sacredheartcathedral.org/(Site address currently being used for both Sacred Heart Church and...

نارايانا غورو معلومات شخصية الميلاد 28 أغسطس 1855 [1][2] الوفاة 20 سبتمبر 1928 (73 سنة) [3] الحياة العملية المهنة فيلسوف، ومدرس اللغات الماليالامية، والسنسكريتية، والتاميلية تعديل مصدري - تعديل نارايانا غورو (20 أغسطس 1856 - 20 سبتمبر 1928)[4] ه...

Artikel ini memuat Teks Tionghoa. Tanpa bantuan render yang baik, anda mungkin akan melihat tanda tanya, kotak-kotak, atau simbol lainnya bukannya Karakter Tionghoa. Ini adalah nama Tionghoa; marganya adalah Soong. Nancy Soong Ai-lingLahir(1888-06-14)14 Juni 1888Shanghai, Dinasti QingMeninggal18 Oktober 1973(1973-10-18) (umur 85)New York City, New York, Amerika SerikatSuami/istriKung Hsiang-hsi (1881–1967), menikah pada 1914AnakKung Ling-iKung Ling-kaiKung Ling-chunKung Ling-chieh...

Сибирский горный козёл Научная классификация Домен:ЭукариотыЦарство:ЖивотныеПодцарство:ЭуметазоиБез ранга:Двусторонне-симметричныеБез ранга:ВторичноротыеТип:ХордовыеПодтип:ПозвоночныеИнфратип:ЧелюстноротыеНадкласс:ЧетвероногиеКлада:АмниотыКлада:СинапсидыКла�...
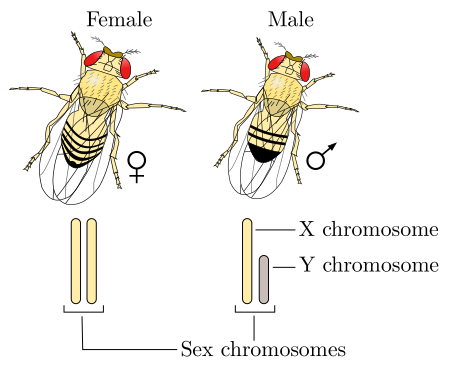
Method of determining sex Part of a series onSex Biological terms Sexual dimorphism Sexual differentiation Feminization Virilization Sex-determination system XY XO ZW ZO Temperature-dependent Haplodiploidy Heterogametic sex Homogametic sex Sex chromosome X chromosome Y chromosome Testis-determining factor Hermaphrodite Sequential hermaphroditism Simultaneous hermaphroditism Intersex (biology) Mating type Sexual reproduction Evolution of sexual reproduction Anisogamy Isogamy Germ cell Meiosis ...

Questa voce o sezione sull'argomento biografie è priva o carente di note e riferimenti bibliografici puntuali. Sebbene vi siano una bibliografia e/o dei collegamenti esterni, manca la contestualizzazione delle fonti con note a piè di pagina o altri riferimenti precisi che indichino puntualmente la provenienza delle informazioni. Puoi migliorare questa voce citando le fonti più precisamente. Segui i suggerimenti del progetto di riferimento. ʿUthmān b. ʿAffān3º califfo del Califfa...

Football match2007 FA Community ShieldMatch programme cover Chelsea Manchester United 1 1 Manchester United won 3–0 on penaltiesDate5 August 2007VenueWembley Stadium, LondonMan of the MatchAshley Cole (Chelsea)RefereeMark Halsey (Lancashire)Attendance80,731WeatherClear27 °C (81 °F)[1]← 2006 2008 → The 2007 FA Community Shield (also known as The FA Community Shield sponsored by McDonald's for sponsorship reasons) was the 85th staging of the FA Community Shiel...

Cet article est une ébauche concernant la géographie et la Bretagne. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants. Aire d'attraction de Dinan Localisation de l'aire d'attraction de Dinan dans le département des Côtes-d'Armor. Géographie Pays France Région Bretagne Département Côtes-d'Armor Caractéristiques Type Aire d'attraction d'une ville Code Insee 187 Catégorie Aires de moins de 50 000 ...

United States Army general (1895–1965) For the author and journalist, see Lucian Truscott IV. Lucian Truscott Jr.Born(1895-01-09)January 9, 1895Chatfield, Texas, United StatesDiedSeptember 12, 1965(1965-09-12) (aged 70)Alexandria, Virginia, United StatesAllegianceUnited StatesService/branchUnited States ArmyYears of service1917–1947RankGeneralService number0-7096UnitCavalry BranchCommands heldThird United States ArmyFifth United States ArmyFifteenth United States ArmyVI Corps3rd...

本表是動態列表,或許永遠不會完結。歡迎您參考可靠來源來查漏補缺。 潛伏於中華民國國軍中的中共間諜列表收錄根據公開資料來源,曾潛伏於中華民國國軍、被中國共產黨聲稱或承認,或者遭中華民國政府調查審判,為中華人民共和國和中國人民解放軍進行間諜行為的人物。以下列表以現今可查知時間為準,正確的間諜活動或洩漏機密時間可能早於或晚於以下所歸�...

Main article: 1992 United Kingdom general election 1992 United Kingdom general election in Northern Ireland ← 1987 9 April 1992 1997 → 17 seats in Northern Ireland of the 650 seats in the House of CommonsTurnout70.0% () First party Second party Leader James Molyneaux John Hume Party UUP SDLP Leader since 1979 6 May 1979 Leader's seat Lagan Valley Foyle Seats won 9 4 Seat change 1 Popular vote 271,049 184,445 Percentage 34.5% 21.1% ...

Alun-Alun Ciamis Alun-Alun Ciamis di sisi barat (2012) Informasi Lokasi Kabupaten Ciamis, Jawa Barat Negara Indonesia Koordinat 7°19′36″S 108°21′11″E / 7.326666°S 108.353111°E / -7.326666; 108.353111Koordinat: 7°19′36″S 108°21′11″E / 7.326666°S 108.353111°E / -7.326666; 108.353111 Pemilik Luas 25.398 m2[1] Fasilitas Lapangan kota Taman bermain Alat kebugaran Trotoar disabilitas Ruang laktasi Toilet Alun-Alun...

هذه المقالة يتيمة إذ تصل إليها مقالات أخرى قليلة جدًا. فضلًا، ساعد بإضافة وصلة إليها في مقالات متعلقة بها. (أبريل 2016) يفتقر محتوى هذه المقالة إلى الاستشهاد بمصادر. فضلاً، ساهم في تطوير هذه المقالة من خلال إضافة مصادر موثوق بها. أي معلومات غير موثقة يمكن التشكيك بها وإزالتها. ...

جواز سفر تايوانيمعلومات عامةنوع المستند جواز سفرالبلد تايوانالغرض التعريف (هوية شخصية)صادر عن تايوانصالح في تايوانمتطلبات الاستحقاق الجنسية التايوانيةتعديل - تعديل مصدري - تعديل ويكي بيانات جواز سفر تايواني (بالصينية: 中華民國 護照؛ بالبينيين: تشونغهوا Zhōnghuá Mínguó hùzhào) [1&...

Dąbrowa Tarnowska ialah sebuah kota besar tua di Provinsi Polandia Kecil, Polandia bagian selatan. Dąbrowa Tarnowska didirikan pada abad ke-16 dan dianugerahi hak kota pada tahun 1693. Serba-serbi Luas wilayah: 23,07 km² Penduduk: 11.435 jiwa (2006) Kepadatan penduduk: 508 jiwa/km² Ketinggian: 120 m dpl Wali kota: Stanisław Początek Kode pos: 33-200 Kode wilayah: +48 14 Plat nomor: KDA Kota kembar Kotamadya distrik Vilnius, Lituania Rixheim, Prancis Wikimedia Commons memiliki media men...

1941 film Dive BomberTheatrical release posterDirected byMichael CurtizScreenplay byFrank WeadRobert BucknerStory byFrank WeadProduced byHal B. WallisStarringErrol FlynnFred MacMurray Alexis Smith Ralph BellamyCinematographyBert GlennonWinton C. HochEdited byGeorge AmyMusic byMax SteinerProductioncompanyWarner Bros.Distributed byWarner Bros.Release date August 30, 1941 (1941-08-30) Running time133 minutesCountryUnited StatesLanguageEnglishBudget$1,201,000[1]Box office$2...