 Tetrahidrofuran
Tetrahidrofuran![]() |
| Substància química | tipus d'entitat química  |
|---|
| Massa molecular | 72,058 Da  |
|---|
| Trobat en el tàxon | |
|---|
|
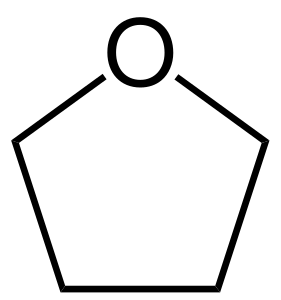
| Fórmula química | C₄H₈O  |
|---|
 |
| SMILES canònic | |
|---|
| Identificador InChI | Model 3D  |
|---|
|
| Densitat | 0,89 g/cm³ (a 20 ℃)  |
|---|
| Viscositat dinàmica | 0,00048 Pl  |
|---|
| Moment dipolar elèctric | 1,63 D i 1,75 D  |
|---|
| Punt de fusió | −108 ℃
−108 ℃
−108,39 ℃  |
|---|
| Punt d'ebullició | 66 ℃ (a 760 Torr)
65 ℃ (a 101,325 kPa)  |
|---|
| Moment dipolar elèctric | 1,63 D i 1,75 D  |
|---|
| Pressió de vapor | 132 mmHg (a 20 ℃)  |
|---|
|
| Límit inferior d'explosivitat | 2 % (V/V)  |
|---|
| Límit superior d'explosivitat | 11,8 % (V/V)  |
|---|
| Límit d'exposició mitjana ponderada en el temps | 590 mg/m³ (10 h, Estats Units d'Amèrica)  |
|---|
| Límit d'exposició a curt termini | 735 mg/m³ (cap valor)  |
|---|
| Punt d'inflamabilitat | 6 °F  |
|---|
| IDLH | 5.900 mg/m³  |
|---|
NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response ()  |
|
líquid inflamable de la classe IB  |
El tetrahidrofuran (THF) o oxolà és un compost orgànic amb la fórmula (CH₂)₄O. És un líquid incolor miscible en aigua amb baixa viscositat. És un compost heterocíclic. És un solvent èter polar amb un ampli rang de ser líquid. Un dels seus principals usos és el de ser precursor de polímers. És menys anestèsic que el dietil èter.
Producció
Es produeixen anualment 200.000 tones de tetrahidrofuran.[1]
Aplicacions
El THF pot ser polimeritzat per àcids forts per a donar un polímer linear anomenat poli(tetrametilen èter) glicol (PTMEG),el principal ús del qual és fibres de poliuretà elastomèriques com Spandex.[2]
El THF també és matèria de partida per fer tetrahidrotiofen.[3]
Com a solvent
El THF és un solvent industrial pel PVC i en vernissos.[4]
Precaucions
El THF es considera un solvent relativament no tòxic, amb (LD50) comparable a la de l'acetona. Ràpidament dissol el làtex i típicament es maneja amb guants de goma de nitril o neoprè. És altament inflamable.
El principal perill del THF és la seva tendència a ser altament explosiu en ajuntar-se amb els peròxids de l'aire.

Referències
- ↑ «Ethers, by Lawrence Karas and W. J. Piel». A: Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc, 2004.
- ↑ «Polyethers, Tetrahydrofuran and Oxetane Polymers by Gerfried Pruckmayr, P. Dreyfuss, M. P. Dreyfuss». A: Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc, 1996.
- ↑ Jonathan Swanston “Thiophene” in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006. doi:10.1002/14356007.a26_793.pub2
- ↑ Herbert Müller, "Tetrahydrofuran" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a26_221
Enllaços externs